

| A. | 从能量转换角度来看,框图中的氯碱工业是一个将电能转化为化学能的过程 | |
| B. | 过程②中结晶出的MgCl2•6H2O要在HCl氛围中加热脱水制得无水MgCl2 | |
| C. | 过程①中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入化学药品的顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 | |
| D. | 在过程③⑤中溴元素均被氧化 |
分析 海水通过蒸发浓缩得到粗盐和母液,粗盐精制除去杂质得到精盐,电解饱和食盐水得到氢氧化钠、氯气和氢气,母液中含有镁离子和溴离子,加入石灰乳沉淀镁离子过滤得到氢氧化镁沉淀和滤液,氢氧化镁溶解后浓缩蒸发,冷却结晶,过滤洗涤,在氯化氢气流中加热失去结晶水得到无水氯化镁,滤液中加入氧化剂氯水氧化溴离子为溴单质,再通入二氧化硫吸收后,加入酸重新生成溴单质,
A、氯碱工业是电解饱和食盐水生成氯气、氢气和氢氧化钠的化学制备反应;
B、氯化镁晶体脱水过程中镁离子易水解生成氢氧化镁沉淀,在氯化氢气体中脱水可以抑制镁离子水解;
C、选项中的试剂添加顺序中,钡离子最后无法除去;
D、依据转化关系的流程中物质反应分析判断,元素化合价升高失电子被氧化.
解答 解:A、氯碱工业是电解饱和食盐水生成氯气、氢气和氢氧化钠的化学制备反应;通电条件下发生了化学反应,电能转化为化学能,故A正确;
B、氯化镁晶体脱水过程中镁离子易水解生成氢氧化镁沉淀,在氯化氢气体中脱水可以抑制镁离子水解;MgCl2•6H20要在HCl氛围中加热脱水制得无水MgCl2,故B正确;
C、试剂添加顺序中,钡离子最后无法除去,则加入的药品顺序为:BaCl2溶液→NaOH溶液→Na2CO3溶液→过滤后加盐酸,故C错误;
D、据转化关系的流程中,③步反应为:2NaBr+Cl2=Br2+2NaCl;④是Br2+SO2+2H2O=H2SO4+2HBr,⑤步的反应为:2HBr+Cl2=Br2+HCl;所以在过程③⑤中溴元素均被氧化,故D正确;
故选C.
点评 本题考查了海水资源的综合利用,涉及物质的鉴别、氧化还原反应、金属的冶炼等知识点,明确反应原理是解本题关键,知道每一步发生的反应,根据物质的性质分析解答,注意溴元素的富集过程,题目难度中等.


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3v(H2)正=2v(NH3)逆 | |
| B. | a molN-N键断裂的同时,有6a mol N-H键断裂 | |
| C. | 混合气体的密度不再随时间变化 | |
| D. | 单位时间生成m mol N2的同时消耗3m mol H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. 或
或 或
或 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
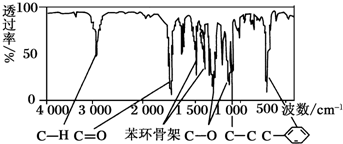
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al2O3、Fe2O3均为两性氧化物 | |
| B. | 该反应中化学能全部转化为热能 | |
| C. | Al2O3中的微粒半径:r(Al3+)>r(O2-) | |
| D. | 在该反应条件下,Al的还原性强于Fe的还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
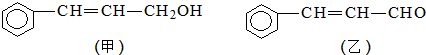
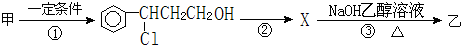
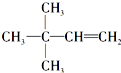
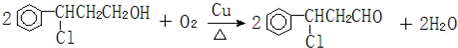 (注明反应条件).
(注明反应条件).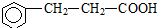 ).写出同时符合下列要求的丙的同分异构体结构简式
).写出同时符合下列要求的丙的同分异构体结构简式 、
、 ,.
,.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
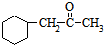 )的流程如图:
)的流程如图: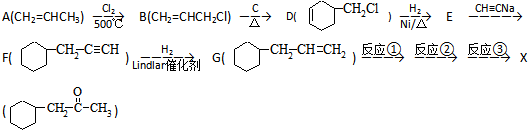 )
)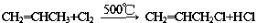 ;写出反应③的化学方程式
;写出反应③的化学方程式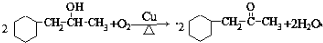 ;
;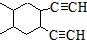 合成线路(其他试剂任选).
合成线路(其他试剂任选).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com