
| A. | 3v(H2)正=2v(NH3)逆 | |
| B. | a molN-N键断裂的同时,有6a mol N-H键断裂 | |
| C. | 混合气体的密度不再随时间变化 | |
| D. | 单位时间生成m mol N2的同时消耗3m mol H2 |
分析 可逆反应N2+3H2?2NH3为气体体积缩小的反应,该反应达到平衡状态时,正逆反应速率相等,各组分的浓度、百分含量不再变化,据此进行解答.
解答 解:A.3v(H2)正=2v(NH3)逆,表示的是正逆反应速率,但是不满足化学计量数关系,说明没有达到平衡状态,故A错误;
B.氮气中存在的是氮氮三键,应该是a molN≡N键断裂的同时,有6a mol N-H键断裂,说明达到平衡状态,故B错误;
C.该反应中气体体积、总质量不发生变化,则气体密度始终不变,不能根据密度判断平衡状态,故C错误;
D.单位时间生成m mol N2的同时消耗3m mol H2,表示的为正反应速率和逆反应速率,且满足计量数关系,说明达到平衡状态,故D正确;
故选D.
点评 本题考查了化学平衡状态的判断,题目难度不大,明确化学平衡状态的特征为解答关键,A为易错点,注意化学反应速率与化学计量数的关系,试题侧重基础知识的考查,培养了学生的灵活应用能力.


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:选择题
| A. | 150 mL 1 mol•L-1的NaCl溶液 | B. | 75 mL 2 mol•L-1 NH4Cl溶液 | ||
| C. | 150 mL 3 mol•L-1的KCl溶液 | D. | 75 mL 3 mol•L-1的FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X中肯定有碳碳双键 | |
| B. | X中可能有三个羟基和一个 一COOR官能团 | |
| C. | X中可能有三个羧基 | |
| D. | X中可能有两个羧基和一个羟基 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 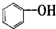 属于醇类化合物 属于醇类化合物 | B. | 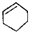 属于芳香族化合物 属于芳香族化合物 | ||
| C. | 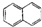 属于脂环化合物 属于脂环化合物 | D. | CH3CH(CH3)2属于链状化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 选用试剂 | 实验现象 | |
| 方案1 | ||
| 方案2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol O2作为氧化剂得到的电子数为2NA | |
| B. | 在0℃,101kPa时,22.4 L氢气中含有NA个氢原子 | |
| C. | NA个一氧化碳分子和0.5 mol甲烷的质量比为7:4 | |
| D. | 25℃,1.01×105Pa,64gSO2中含有的原子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 从能量转换角度来看,框图中的氯碱工业是一个将电能转化为化学能的过程 | |
| B. | 过程②中结晶出的MgCl2•6H2O要在HCl氛围中加热脱水制得无水MgCl2 | |
| C. | 过程①中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入化学药品的顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 | |
| D. | 在过程③⑤中溴元素均被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 表述1 | 表述2 | |
| A | 在水中,NaCl的溶解度比I2的溶解度大 | NaCl晶体中Cl-与Na+间的作用力大于碘晶体中分子间的作用力 |
| B | 通常条件下,CH4分子比GeH4分子稳定性高 | Ge的原子半径比C的大,Ge与H之间的键能比C与H间的小 |
| C | 向溴乙烷中加入NaOH水溶液,加热反应,再加入AgNO3溶液有浅黄沉淀 | 证明溴乙烷中含有溴原子 |
| D | P4O10、C6H12O6溶于水后均不导电 | P4O10、C6H12O6均属于共价化合物 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com