
| 表述1 | 表述2 | |
| A | 在水中,NaCl的溶解度比I2的溶解度大 | NaCl晶体中Cl-与Na+间的作用力大于碘晶体中分子间的作用力 |
| B | 通常条件下,CH4分子比GeH4分子稳定性高 | Ge的原子半径比C的大,Ge与H之间的键能比C与H间的小 |
| C | 向溴乙烷中加入NaOH水溶液,加热反应,再加入AgNO3溶液有浅黄沉淀 | 证明溴乙烷中含有溴原子 |
| D | P4O10、C6H12O6溶于水后均不导电 | P4O10、C6H12O6均属于共价化合物 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.溶解度与离子键、分子间作用力的强弱无关;
B.分子的键能越大,分子越稳定;
C.加入硝酸银前需要用稀硝酸酸化,否则干扰实验结果;
D.共价化合物类型的电解质的水溶液能导电.
解答 解:A.溶解度与离子键、分子间作用力的强弱无关,碘为非极性分子,难以溶于极性溶剂,故A错误;
B.CH4分子比SiH4分子稳定性高的原因是C与H间的键能大于Si与H之间的键能,故B正确;
C.向溴乙烷中加入NaOH水溶液,加热反应,必须先加入硝酸酸化后再加入AgNO3溶液,否则氢氧根离子与银离子反应,干扰了实验检验结果,故C错误;
D.共价化合物类型的电解质的水溶液能导电,电解质既有离子化合物,也有共价化合物,故D错误;
故选B.
点评 本题考查了化学实验方案的评价,题目难度中等,侧重物质结构与性质知识的考查,C为易错点,注意加入硝酸银溶液前需要中和氢氧根离子,试题培养了学生的分析、理解能力及化学实验能力.


 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 3v(H2)正=2v(NH3)逆 | |
| B. | a molN-N键断裂的同时,有6a mol N-H键断裂 | |
| C. | 混合气体的密度不再随时间变化 | |
| D. | 单位时间生成m mol N2的同时消耗3m mol H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al2O3、Fe2O3均为两性氧化物 | |
| B. | 该反应中化学能全部转化为热能 | |
| C. | Al2O3中的微粒半径:r(Al3+)>r(O2-) | |
| D. | 在该反应条件下,Al的还原性强于Fe的还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
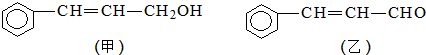
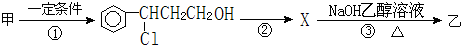
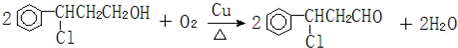 (注明反应条件).
(注明反应条件).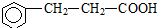 ).写出同时符合下列要求的丙的同分异构体结构简式
).写出同时符合下列要求的丙的同分异构体结构简式 、
、 ,.
,.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
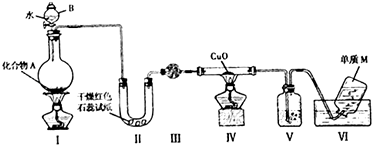
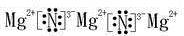 ,A与水反应的化学方程式Mg3N2 +6H2O=3Mg(OH)2↓+2NH3↑,比较A中阴阳离子的大小,阳离子半径小于阴离子半径(填大于,小于或等于)
,A与水反应的化学方程式Mg3N2 +6H2O=3Mg(OH)2↓+2NH3↑,比较A中阴阳离子的大小,阳离子半径小于阴离子半径(填大于,小于或等于)查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
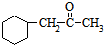 )的流程如图:
)的流程如图: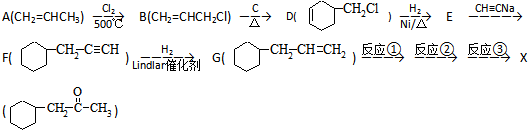 )
)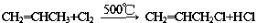 ;写出反应③的化学方程式
;写出反应③的化学方程式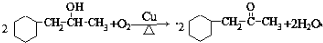 ;
;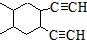 合成线路(其他试剂任选).
合成线路(其他试剂任选).查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 A、B、C、D、E为原子序数依次增大的五种短周期元素,其中仅含有一种金属元素,A和D最外层电子数相同;B、C和E在周期表中相邻,且C、E同主族.B、C的最外层电子数之和等于D的原子核外电子数,A和C可形成两种常见的液态化合物.
A、B、C、D、E为原子序数依次增大的五种短周期元素,其中仅含有一种金属元素,A和D最外层电子数相同;B、C和E在周期表中相邻,且C、E同主族.B、C的最外层电子数之和等于D的原子核外电子数,A和C可形成两种常见的液态化合物.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com