

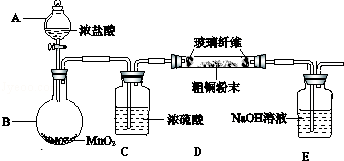
分析 粗铜中含有Fe,与氯气反应生成CuCl2和FeCl3,为防止水解,应加入过量的稀盐酸进行溶解,并保证金属完全反应,溶液1中的金属离子有Fe3+、Fe2+、Cu2+,加入试剂X目的是将溶液中Fe2+氧化为Fe3+,应为H2O2,还原得到水,是绿色氧化剂,通过调节pH,使溶液中Fe3+转化为Fe(OH)3沉淀,过滤分离,且加入Y可以消耗氢离子且不能引入新杂质,可以为CuO、Cu(OH)2、CuCO3、Cu2(OH)2CO3.滤液经过加热浓缩、冷却结晶、过滤、洗涤、干燥得到CuCl2•2H2O,
(1)Fe2+具有还原性,可以使酸性高锰酸钾溶液褪色;能与K3[Fe(CN)6]反应得到蓝色铁氰化亚铁蓝色沉淀;加入试剂X目的是将溶液中Fe2+氧化为Fe3+,最好应为H2O2;
(2)调节pH至4~5之间,液中Fe3+转化为Fe(OH)3沉淀,Cu2+离子不沉淀,过滤分离;
(3)由于HCl不影响氯气和粗铜的反应的产物,且可以抑制氯化铜水解,氯气中混有的HCl不需要除去;
(4)实验所需480mL10mol/L浓HCl配制时用到的玻璃仪器有:量筒、烧杯、玻璃棒、胶头滴管、500mL容量瓶;
(5)该装置缺少防止倒吸装置,在D、E之间添加防倒吸的安全瓶;
(6)CuCl2•xH2O晶体加热容易分解,且氯化铜易水解,应在HCl气流中低温烘干;
(7)氯化铜溶液中加入足量氢氧化钠溶液、过滤得到沉淀为氢氧化铜,沉淀洗涤的操作方法是:向过滤器中加入水至完全浸没沉淀,过滤,重复2~3次;
氢氧化铜加热分解所得黑色固体的质量ng为CuO,根据Cu元素守恒计算CuCl2•xH2O的物质的量,再结合m=nM计算x的值.
解答 解:(1)①Fe2+具有还原性,可以使酸性高锰酸钾溶液褪色,用高锰酸钾溶液可以检验Fe2+,故正确;
②Fe2+能与K3[Fe(CN)6]反应得到蓝色铁氰化亚铁蓝色沉淀,故正确;
③铁离子、铜离子均与NaOH反应生成沉淀,影响亚铁离子检验,故错误;
④铁离子与KSCN反应,溶液呈红色,不能检验Fe2+,故错误;
加入试剂X目的是将溶液中Fe2+氧化为Fe3+,X应为H2O2,还原得到水,是绿色氧化剂,
故答案为:①②;H2O2;
(2)由上述分析可知,试剂X为盐酸,加入过量的盐酸,充分反应,抑制Cu2+水解;
加入Y可以消耗氢离子调节溶液pH,使溶液中Fe3+转化为Fe(OH)3沉淀,过滤分离,且不能引入新杂质,
a.NaOH引入杂质钠离子,故a错误;
b.NH3•H2O 引入铵根离子,故b错误;
c.CuO可以调节PH值,除去杂质,过量的CuO过滤除去,不引入杂质,故c正确;
d.Cu2(OH)2CO3 可以调节PH值,除去杂质,过量的Cu2(OH)2CO3 过滤除去,不引入杂质,故d正确;
e.CuSO4不能调节PH值,引入硫酸根离子,故e错误;
调节pH至4~5之间,使溶液中Fe3+转化为Fe(OH)3沉淀,Cu2+离子不沉淀,
故答案为:cd;使溶液中Fe3+转化为Fe(OH)3沉淀,Cu2+离子不沉淀;
(3)HCl对反应没有影响,且可以抑制氯化铜水解,不需要在浓硫酸洗气瓶前增加吸收HCl的装置,
故答案为:否;HCl不参与反应,且能抑制Cu2+水解;
(4)实验所需480mL10mol/L浓HCl配制时用到的玻璃仪器有:量筒、烧杯、玻璃棒、胶头滴管、500mL容量瓶,
故答案为:胶头滴管、500mL容量瓶;
(5)该装置缺少防止倒吸装置,在D、E之间添加防倒吸的安全瓶,
故答案为:缺少防止倒吸装置安全瓶;
(6)CuCl2•xH2O晶体加热容易分解,且氯化铜易水解,应在HCl气流中低温烘干,
故答案为:D;
(7)氯化铜溶液中加入足量氢氧化钠溶液、过滤得到沉淀为氢氧化铜,沉淀洗涤的操作方法是:向过滤器中加入水至完全浸没沉淀,过滤,重复2~3次;
氢氧化铜加热分解所得黑色固体的质量ng为CuO,根据Cu元素守恒:n(CuCl2•xH2O)=n(CuO)=$\frac{n}{80}$mol,则$\frac{n}{80}$mol×(135+18x)=mg,解得x=$\frac{80m-135n}{18n}$,
故答案为:向过滤器中加入水至完全浸没沉淀,过滤,重复2~3次;$\frac{80m-135n}{18n}$.
点评 本题考查化学工艺流程及实验制备,涉及对实验装置与操作及试剂的分析评价、物质分离提纯、化学平衡移动、化学计算等,要求学生具备扎实的基础与综合运用能力,难度很大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
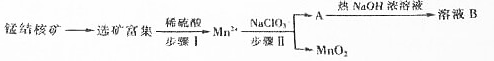
| 化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-17 | 10-17 | 10-39 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
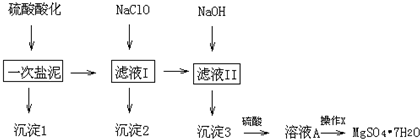
| 物质 | 开始沉淀 | 完全沉淀 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |
| Mg(OH)2 | 9.6 | 11.1 |
| Al(OH)3 | 3.7 | 5.7 |
| 开始溶解:7.8 | 完全溶解:10.0 |
查看答案和解析>>
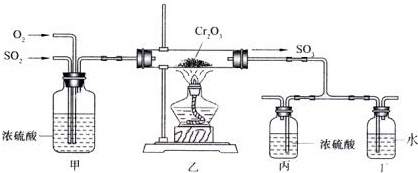
科目:高中化学 来源: 题型:选择题
| A. | 平衡常数不变 | B. | n(O2)增大 | ||
| C. | SO2的体积分数增大 | D. | c(SO2)增大 |
查看答案和解析>>
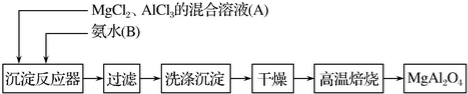
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 明矾净水时使水中悬浮颗粒沉淀 | |
| B. | 清晨树林中的道道光柱 | |
| C. | 雾霾天气打手电能看到明显的光柱 | |
| D. | 澄清石灰水中通入CO2气体,有白色的沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3与过量NaOH溶液反应生成AlO2-,则与过量NH3•H2O反应也生成AlO2- | |
| B. | Al与Fe2O3能发生铝热反应,则与MnO2也能发生铝热反应 | |
| C. | Fe与Cl2反应生成FeCl3,则与I2反应可生成FeI3 | |
| D. | Na2O2与CO2反应生成Na2CO3和O2,则与SO2反应可生成Na2SO3和O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com