
【题目】向50mL NaOH溶液中通入一定量的CO2(假设溶液体积不变),随后取溶液10mL,将其稀释至100mL,并向此稀释后的溶液中逐滴加入0.1molL﹣1的盐酸,产生CO2气体的体积(标准状况下)与所加盐酸的体积关系如图所示。

(1)写出OA段所发生反应的离子方程式: .
(2)NaOH在吸收CO2后,所得溶液的溶质为 ,其物质的量浓度之比为 .
(3)产生的CO2体积(标准状况下)为 .
(4)原NaOH溶液的物质的量浓度为 .
【答案】(10分)
(1)OH-+H+==H2O CO32-+H+==HCO3-(2分)
(2)NaOH、Na2CO3 (2分) 1:1 (2分)
(3)56mL 或0.056L (2分)
(4)0.75mol/L (2分)
【解析】
试题分析:当生成CO2气体时,发生反应NaHCO3+HCl=NaCl+H2O+CO2↑,由图可知,生成CO2气体至最大,消耗HCl为75mL,若二氧化碳与NaOH反应后溶液中只有Na2CO3,由Na2CO3+HCl=NaHCO3+NaCl可知,将Na2CO3转化为NaHCO3应消耗HCl为25mL,而图象中开始生成CO2气体时消耗HCl体积为50mL,说明该阶段还发生反应:NaOH+HCl=NaCl+H2O,溶液中溶质为NaOH、Na2CO3,
(1)由上述分析可知OA段所发生反应的离子方程式:H++OH﹣═H2O、CO32﹣+H+═HCO3﹣;
(2)中和NaOH消耗HCl的体积为50mL﹣25mL=25mL,由方程式可知NaHCO3和Na2CO3的物质的量之比等于两个过程分别消耗盐酸的体积之比,故NaOH、Na2CO3的物质的量之比=25mL:25mL=1:1,浓度之比是1:1,故答案为:NaOH、Na2CO3;1:1;
(3)生成二氧化碳消耗消耗25mL盐酸,根据NaHCO3+HCl=NaCl+H2O+CO2↑,可知CO2体积(标准状况下)为0.025L×0.1mol/L×22.4L/mol=0.056L=56mL,故答案为:56mL;
(4)生成CO2气体最大时,此时溶液中溶质为NaCl,根据钠离子、氯离子守恒可知n(NaOH)=n(NaCl)=n(HCl)=0.075L×0.1mol/L=0.0075mol,故原氢氧化钠溶液的浓度=![]() =0.75mol/L,故答案为:0.75mol/L。
=0.75mol/L,故答案为:0.75mol/L。


科目:高中化学 来源: 题型:
【题目】重氮甲烷(CH2N2)能与酸性物质反应:R-COOH+CH2N2→R-COOCH3+N2。下列物质中能与重氮甲烷反应但产物不是酯的是( )
A. H-CHO B. C6H5OH C. C6H5CH2OH D. C6H5COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将5.10g镁铝合金加入120mL4.0mol·L-1的盐酸中,待合金完全溶解后,得到溶液X。下列说法一定正确的是
A. 合金完全溶解后产生的H2的物质的量为0.24mol
B. 合金中的镁与铝的物质的量之比小于1
C. 若向溶液X中加入270mL2.0mol·L-1NaOH溶液,充分反应,所得沉淀为Mg(OH)2
D. 若向溶液X中加入足量的氨水,充分反应,所得沉淀经过过滤、洗涤后充分灼烧,则残留固体质量大于8.50g.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向H2O2溶液中加入适量稀硫酸酸化的硫酸亚铁溶液,依次观察到如下现象:①反应刚开始,仅有少量气泡产生;②反应片刻后,有大量气泡产生;③试管底部最终出现红褐色沉淀。下列判断正确的是
A.①中仅发生一个反应 B.Fe3+能催化H2O2的分解
C.反应过程中溶液酸性不变 D.FeSO4与等物质的量的H2O2恰好反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,不属于取代反应的是 ( )
A. 在催化剂存在条件下苯与液溴反应制溴苯
B. 苯与浓硝酸、浓硫酸混合共热制取硝基苯
C. 苯与浓硫酸共热制取苯磺酸
D. 在一定条件下苯与氢气反应制环己烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语表示正确的是
A.CO2的比例模型:![]()
B.中子数为18的氯原子的原子符号:18Cl
C.18O2-的结构示意图: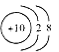
D.N2分子的电子式:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用生产钛白的副产品绿矾(FeSO47H2O)制备还原铁粉的步骤如下:将绿矾溶于稀硫酸溶液,向其中滴加(NH4)2CO3溶液,得到FeCO3nH2O沉淀,静置,过滤,洗涤,干燥,再将FeCO3与煤粉一起焙烧,最终制得还原铁粉。涉及的主要反应有:
FeCO3![]() FeO+CO2,
FeO+CO2,
C+CO2![]() 2CO,
2CO,
CO+FeO![]() Fe+CO2,
Fe+CO2,
(1)检验绿矾是否已有部分氧化的方法是 。
(2)证明沉淀已经洗涤干净的方法是 。
(3)干燥过程中少量FeCO3nH2O被氧化为FeOOH,反应方程式为: 。
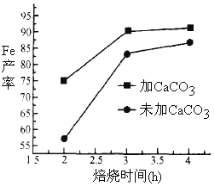
(4)实际生产中,所得沉淀仍含少量硫酸盐,在焙烧过程中需加入CaCO3进行脱硫处理,上图为加CaCO3和不加CaCO3对还原铁粉的产率的影响,根据图像分析,CaCO3的另一作用为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com