
【题目】无机化合物可根据其组成和性质进行分类,
(1)如图所示的物质分类方法名称是 .
(2)如下表格
物质类别 | 酸 | 碱 | 盐 | 酸性 | 碱性 |
化学式 | ①② | ③④Ba(OH)2 | ⑤Na2CO3 | ⑦SO2 | ⑨﹣﹣ |
以Na、K,H,O,C,S,N中任两种或三种元素组成合适的物质,分别填在上表中①②③⑥⑧⑨⑩后面的横线上.
(3)写出少量的⑦通入NaOH溶液的化学方程式: .
(4)实验室制备⑦常用和反应,检验该气体的方法是
(5)写出④与⑤反应的离子方程式 .
【答案】
(1)树状分类法
(2)H2SO4、H2SO3、HNO3、H2CO3;H2S;NaOH、KOH、NH3 . H2O;Na2SO3、NaNO3、K2SO4、K2CO3、KNO3
(3)SO2+2NaOH=Na2SO3+H2O
(4)Na2SO3;浓H2SO4;气体通过品红溶液褪色,加热恢复红色,证明为二氧化硫
(5)Ba2++CO32﹣=BaCO3↓
【解析】解:(1)树状分类法是一种很形象的分类法,按照层次,一层一层来分,就像一棵大树,有叶、枝、杆、根,图示方法就是树状图,
所以答案是:树状分类法;(2)酸电离出的阳离子全部是氢离子的化合物,如含氧酸为H2SO4、H2SO3、HNO3、H2CO3 , 无氧酸为:H2S,碱电离出的阴离子全部为氢氧根离子,如NaOH、KOH、NH3 . H2O;盐电离出得阳离子为金属离子,阴离子为酸根离子,如Na2SO3、NaNO3、K2SO4、K2CO3、KNO3 , 酸性氧化物和碱反应生成盐和水的氧化物,如SO2、SO3、CO2、N2O5 . 碱性氧化物是和酸反应生成盐和水的氧化物,如Na2O、K2O,
所以答案是:
物质类别 | 酸 | 碱 | 盐 | 酸性 | 碱性 |
化学式 | ①H2SO4、H2SO3、HNO3、H2CO3 | ③NaOH、KOH、NH3 . H2O | ⑥Na2SO3、NaNO3、K2SO4、K2CO3、KNO3 | ⑦SO2 | ⑨Na2O |
3)少量的⑦位SO2通入NaOH溶液发生反应生成亚硫酸钠和水,反应的化学方程式为:SO2+2NaOH=Na2SO3+H2O,
所以答案是:SO2+2NaOH=Na2SO3+H2O;(4)实验室制备⑦常用亚硫酸钠和浓硫酸反应生成硫酸钠、二氧化硫和水,反应的化学方程式为:Na2SO3+H2SO4=Na2SO4+CO2↑+H2O,检验该气体的方法是:二氧化硫气体具有漂白性,气体通过品红溶液褪色,加热恢复红色,证明为二氧化硫,
所以答案是:Na2SO3;浓H2SO4;气体通过品红溶液褪色,加热恢复红色,证明为二氧化硫;(5)④与⑤反应是Ba(OH)2 和Na2CO3 反应生成碳酸钡和氢氧化钠,反应的离子方程式为:Ba2++CO32﹣=BaCO3↓,
所以答案是:Ba2++CO32﹣=BaCO3↓.


 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案科目:高中化学 来源: 题型:
【题目】向一定体积的Ba(OH)2溶液中逐滴加入稀硫酸,溶液的导电性(以电流I表示)滴入的稀硫酸的体积(用V表示)间的关系最接近真实情况的是( )
A.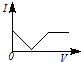
B.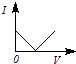
C.
D.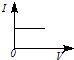
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铁矿石的主要成分为FeS2和少量FeS(假设其他杂质中不含Fe、S元素,且高温下不发生化学变化),是我国大多数硫酸厂制取硫酸的主要原料。某化学兴趣小组对该黄铁矿石进行如下实验探究。将m1 g该黄铁矿石的样品放入如图装置(夹持和加热装置略)的石英管中,从a处不断地缓缓通入空气,高温灼烧黄铁矿样品至反应完全。其反应的化学方程式为:
![]()

【实验一】:测定硫元素的含量
反应结束后,将乙瓶中的溶液进行如下处理:

①鼓入空气的作用是_________________________________。
②反应结束后乙瓶中的溶液需加足量H2O2溶液的目的是(用化学方程式表示)________________________________________。
H2O2可以看作是一种很弱的酸,写出其电离方程式:_____________________。
(3)该黄铁矿石中硫元素的质量分数为______________(列出表达式即可)。
【实验二】:测定铁元素的含量

(4)②中,若用铁粉作还原剂,则所测得的铁元素的含量____________(填“偏大”、“偏小”或“无影响”)。
(5)③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有_________________。
(6)某同学一共进行了四次滴定实验,实验结果记录如下:
实验次数 | 第一次 | 第二次 | 第三次 | 第四次 |
消耗KMnO4溶液体积/mL | 25.00 | 25.03 | 20.00 | 24.97 |
根据所给数据,计算该稀释液中Fe2+的物质的量浓度为c(Fe2+) =_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在A、B、C三个烧杯中分别盛有相同浓度的稀硫酸,如图所示:

(1)A中反应的离子方程式为_____________________________。
(2)B中Sn极的电极反应式为____________________________,Sn极附近溶液的pH________(填“增大”“减小”或“不变”)。
(3)C中被腐蚀的金属是________,总反应的离子方程式为________________,比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】要证明某溶液中不含Fe3+而可能含Fe2+,进行如下实验操作时,最佳的顺序是( )
①加足量氯水 ②加足量KMnO4溶液 ③加入少量KSCN溶液
A.①② B.③② C.③① D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A,B,C,D,E,F六种化合物,它们之间的反应关系如下所示:
①A+B→C+E
②C+NaOH→蓝色沉淀D+F
③D ![]() A+E
A+E
④F+Ba(NO3)2→白色沉淀+NaNO3
回答下列问题:
(1)写出它们的化学式:
ABCDEF
(2)写出①②④的离子反应方程式:
①
②
④ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列叙述正确的是
A. 标准状况下,22.4LH2O含有的分子数为NA
B. 常温常压下,NA个CO2分子占有的体积为22.4L
C. 常温常压下,1.06g Na2CO3含有的Na+离子数为0.02NA
D. 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl- 个数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是以化合物I为原料合成一种香精(化合物Ⅵ)的合成路线,反应在一定条件下进行.化合物Ⅵ广泛用于香精的调香剂.
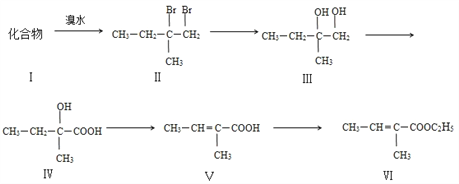
回答下列问题:
(1)化合物Ⅰ生成化合物Ⅱ的反应原子利用率可达100%,化合物Ⅰ的结构简式为______________,该化合物核磁共振氢谱中有____________个吸收峰;
(2)化合物Ⅱ生成化合物Ⅲ发生______________反应,其方程式为____________________________(注明反应条件);
(3)化合物Ⅴ有多种同分异构体.请写出与化合物Ⅴ官能团种类相同且无支链的所有同分异构体的结构简式______________________________________________________________________;
(4)化合物Ⅵ不能发生的反应类型是______________(填字母).
A.加成反应 B.酯化反应 C.水解反应 D.加聚反应
(5)写出化合物Ⅵ在一定条件下反应,生成高分子化合物的化学方程式:______________________________________(不需注明条件).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com