
����Ŀ����֪��NOx����Na2O2��Ӧ��NO��NO2����������KMnO4��Һ��Ӧ����NO3����Mn2+��
I.����ͼ��ʾװ��(��ȥ�г�����)���Ƶ�������������(2NO+Na2O2=2NaNO2)��

��1��B��D������������________��D��������________��
��2��ͨNOǰ������ͨһ��ʱ��N2��Ŀ����________��
��3��E����Ҫ��Ӧ�����ӷ���ʽΪ________��
��4�������£����ʵ��ǰ��C��������ֵΪ0.30g�����Ƶ�NaNO2________g��
��.NO2��Na2O2���н�ǿ�����ԣ�Ϊ̽��NO2��Na2O2��Ӧ�IJ��������¼��裺
����i.NO2����Na2O2������ii.Na2O2����NO2��
��ͬѧ�����ͼ��ʾʵ��װ�ã�

��ش��������⣺
��5��������ʵ�����嵥����ͨ��ͬʱ������һ��������___________��
��6�����Թ�G���ռ������壬���Թ�G�м�������Na2O2��ĩ���������ӣ��������Թ��ڷ�ĩ���۲쵽����ɫ����Ѹ����ʧ���ٽ������ǵ�ľ��Ѹ������Թ��ڣ�ľ����ȼ����ͬѧ�ݴ���Ϊ����i��ȷ����ͬѧ��Ϊ��װ�ò��ܴﵽʵ��Ŀ�ģ�Ϊ�ﵽʵ��Ŀ�ģ�Ӧ��F��G֮������һ��Mװ�ã�M��Ӧʢװ__________(�ɹ�ѡ����Լ�����ʯ�ң�Ũ���ᱥ���Ȼ�����Һ)����ͬѧ�øĽ����װ�ã��ظ��˼�ͬѧ��ʵ��������۲쵽����ɫ����Ѹ����ʧ�������ǵ�ľ��δ��ȼ���õ����ۣ���������ȷ��
��������ȷ�жϣ�д��NO2��Na2O2��Ӧ�Ļ�ѧ����ʽ__________
���𰸡� (����)����� ��ֹˮ��������Cװ�� �ų�װ���еĿ��� 4H++3MnO4-+5NO=3Mn2++5NO3-+2H2O 0.69g ��ֹ���� Ũ���� 2NO2+Na2O2=2NaNO3
����������ʵ��������֣�I��ʵ��Ŀ������ȡ�����������ƣ����ݷ�Ӧ��2NO+Na2O2=2NaNO2��Na2O2������ˮ��Ӧ�����Ը�ʵ��Ĺؼ�����ȫ���
��1��B��D������������(����)����ܣ�B��D�����ö��Ƿ�ֹˮ��������Cװ�ã�
��2��ͨNOǰ������ͨһ��ʱ��N2������Ҫ��װ���еĿ����ų�ȥ����Ϊ����NaNO2���ױ���������Ŀ�����ų�װ���еĿ�����
��3��װ��E������������δ��Ӧ���NO������������Ϣ��NO��NO2����������KMnO4��Һ��Ӧ����NO3����Mn2+����C����Ҫ��Ӧ�����ӷ���ʽΪ��4H++3MnO4-+5NO=3Mn2++5NO3-+2H2O��
��4�������£����ʵ��ǰ��C��������ֵΪ0.30g�����ݷ�Ӧԭ����2NO+Na2O2=2NaNO2��װ�����ؼ�ΪNO����������n��NO��=n��NaNO2��0.1mol��m��NaNO2��=0.69g��
��.��ʵ���Ŀ����̽��NO2��Na2O2��Ӧ�IJ��NO2��Na2O2���н�ǿ�����ԡ�
��5��������G��H֮�䣬�����ڲ���һ���ؼ���Բ״�ṹ��ʵ�����嵥����ͨ��ͬʱ������һ�������ǿ������Һ�壬��ֹ������
��6�����Թ�G���ռ������壬���Թ�G�м�������Na2O2��ĩ���������ӣ��������Թ��ڷ�ĩ���۲쵽����ɫ����Ѹ����ʧ���ٽ������ǵ�ľ��Ѹ������Թ��ڣ�ľ����ȼ��˵��NO2��Ӧ���ˣ�������O2,��������F�е�ˮ��������G����NO2��Na2O2��Ӧ����F��G֮������һ��Mװ�ã���������ˮ������M��ӦʢװŨ����øĽ����װ�ã��ظ��˼�ͬѧ��ʵ��������۲쵽����ɫ����Ѹ����ʧ�������ǵ�ľ��δ��ȼ��˵����Ӧ�ˣ���δ����O2��������Na2O2����NO2������������NaNO3�����䷴Ӧ����ʽΪ��2NO2+Na2O2=2NaNO3��


 ��������ϵ�д�
��������ϵ�д� ��ӡ�Ļ���ʱ����ϵ�д�
��ӡ�Ļ���ʱ����ϵ�д� ��ѧ�����ϵ�д�
��ѧ�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ϊ���ֶ�����Ԫ�ص�����,�ش���������:
Ԫ�ر�� | A | B | C | D | E | F | G | H |
ԭ�Ӱ뾶/10-1nm | 0.74 | 1.54 | 1.30 | 1.18 | 1.11 | 1.06 | 0.99 | 0.75 |
�����ͻ��ϼ� | -2 | +1 | +2 | +3 | +4��-4 | +5��-3 | +7��-1 | +5��-3 |
(1)EԪ����Ԫ�����ڱ��е�λ����_____��CԪ����GԪ���γɻ�����ĵ���ʽ_____ ��
(2)D�ĵ�����B������������Ӧˮ�������Һ��Ӧ,�����ӷ���ʽΪ_________��
(3)B2A2�к��еĻ�ѧ��Ϊ_______����������ˮ��Ӧ�Ļ�ѧ��Ӧ����ʽΪ________��
(4)����˵������ȷ����______(�����)��
��H����̬�⻯��ˮ��Һ�ܵ��磬˵��H����̬�⻯��Ϊ�����
������������Ӧˮ����ļ���:B>C>D
��D������������Ӧˮ����������ڰ�ˮ
��Ԫ����̬�⻯����ȶ���:F>A>G
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʼ��ܷ�����ȥ��Ӧ������������ȩ���ǣ�������
A.���״�
B.2��2��������1������
C.2������1������
D.�״�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����������A�������ʽΪC6H12O2 �� ʵ�����A������������Һ��������B��C��B�����ᷴӦ�����л���D��C��ͭ���ͼ��ȵ�����������ΪE������D��E�����ܷ���������Ӧ���ɴ��ж�A�Ŀ��ܵĽṹ�У�������
A.6��
B.2��
C.4��
D.3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݵĿ����Դ�ḻ����ȫ��ռ���Ƶ�λ���������ס�ú���̡��ؾ�ʯ���ƽ�Ǧп������ڶ�Ʒ�֡��ش��������⣺
��1����Ԫ������ͭ��Ԫ�أ�ԭ�ӽṹ��ͭ���ƣ���Ԫ�����ڱ���λ�ڵ������ڣ���̬��ԭ�ӵ���Χ�����Ų�ͼΪ__________��Cu2+����������ӻ�����γ��ȶ��Բ�ͬ��������X���������������̪ݼͭ�ľ���ṹ����ֲ��ṹ��ͼ��ʾ��
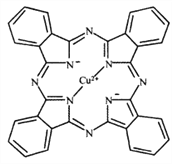
��̪ݼͭ�ṹ�зǽ���Ԫ�ص縺���ɴ�С��˳��Ϊ__________��
��̪ݼͭ�ṹ��Nԭ�ӵĹ���ӻ�����Ϊ__________��̪ݼͭ�ṹ�в����ڵĻ�ѧ������Ϊ__________
A.��� B.������ C.���� D.����
��2��úͨ������������Һ���ɻ�����ȼ�ϺͶ��ֻ���ԭ�ϣ���������֮һ��NH3�� VSEPRģ��Ϊ__________��
��3���̡�����Ԫ���е��������ܽϴ����__________(��Ԫ�ط���)��ԭ����___________��
��4���ڻ�п(ZnTe)���п����������ԣ������������뵼����ϣ��ڻ�п�������������������־��ͣ������������ṹ����ͼ��ʾ��
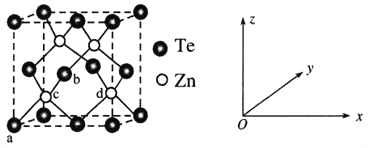
��ԭ�����������ʾ�����ڲ���ԭ�ӵ����λ�á���֪a��b��c��ԭ����������ֱ�Ϊ(0��0��0)��(![]() ��0��
��0��![]() )��(
)��(![]() ��
��![]() ��
��![]() )����d��ԭ���������Ϊ__________��
)����d��ԭ���������Ϊ__________��
�����������������Teԭ�Ӽ����Ϊapm�������ܶ�Ϊ__________g/cm3(��ʽ����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪������±�����ڴ����������¿��������������±���⣬C�������г������л��75%��C��Һ������ҽ���������ұ��ܱ����Ը��������Һ����Ϊ�����ᣮ��������֮���ת����ϵ��ͼ��ʾ�����������������������ȥ����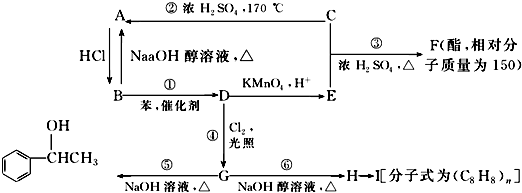
��ش��������⣺
��1��д�����ʵĽṹ��ʽ��D��I ��
��2���ڢ١���6����Ӧ�У�������ȥ��Ӧ���������ţ���
��3��д�����з�Ӧ�Ļ�ѧ����ʽ��
����
����
��4��д��һ�ַ�������Ҫ���F��ͬ���칹��Ľṹ��ʽ��F��ͬ���칹�����������࣬�ܷ���������Ӧ���ұ����ϵ�һ��ȡ����ֻ�����֣� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2019�꾩��ʯ��ׯ)��ʳ�Ļ�����9��11�տ�Ļ��ȫ������200������ɫС��ǿ����פ������ʳ�����ҪӪ���ɷֲ��ǵ����ʵ���
A.�����ִ�ţ����B.�Ӽ�¿�����C.��̨�����ռ�D.�����ײ˾�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й����Ҵ���˵����ȷ���ǣ� ��
A.����������ȼ��
B.�ܸ�ʴ��������
C.����NaOH��Һ��Ӧ
D.�ܱ�Cu��������C02
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��
����β���еĵ������������ǵ���������Ҫԭ��֮һ����ش������й�β�����������⣺
��1���û�ѧ����ʽ��������β���к���NO��ԭ��_______________________________��
��2�������������ڰ�װ�Ĵ�ת��������ʹ����β���е���Ҫ��Ⱦ��NO��COת��Ϊ���Ĵ���ѭ�����ʡ�
��֪��N2(g)+O2(g)=2NO(g) ��H=+180.5kJmol-1
2C(s)+O2(g)=2CO(g) ��H= -221.0kJmol-1
C(s)+O2(g)=CO2(g) ��H= -393.5 kJmol-1
�������Ӧ2NO(g)+2CO(g)=N2(g)+2CO2(g)�ġ�H= ___________kJmol-1��
��3����0.20mol NO��0.10molCO����һ���ݻ��㶨Ϊ1L���ܱ������У��ڲ�ͬ�����·�Ӧ�����в������ʵ�Ũ�ȱ仯״����ͼ1��ʾ��
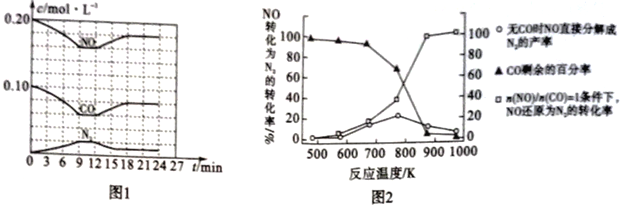
�ټ��㷴Ӧ�ڵ�9-12 minʱ��ƽ�ⳣ��K=____________��
�ڵ�12 minʱ�ı�ķ�Ӧ����������_____________(��дһ��)��
��4��ij�о�������ʵ������Ag-ZSM-5Ϊ��������õ�λʱ����NOת��ΪN2��ת�������¶ȱ仯�����ͼ2��ʾ��
������ʹ��CO�����ֵ��¶ȳ���775 Kʱ��NO�ķֽ��ʽ��ͣ�����ܵ�ԭ����________________��
����n(NO)/n(CO) =1�������£�Ϊ���õس�ȥNO��Ӧ���Ƶ�����¶�Ӧ��____ K���ҡ�
��5�������������ˮ���ת��ΪNO3-���绯ѧ���ⷨ����������ˮ��NO3-����Ⱦ��ԭ������ͼ��ʾ�����Դ����Ϊ______��ѡ�A����B�����������缫��ӦʽΪ__________________��
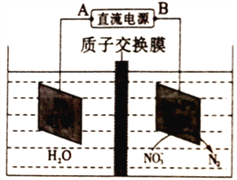
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com