
【题目】下列关于乙醇的说法正确的是( )
A.能用作汽车燃料
B.能腐蚀铁制容器
C.能与NaOH溶液反应
D.能被Cu催化氧化成C02
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究,其结构简式如图所示.下列关于分枝酸的叙述正确的是( ) 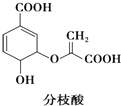
A.分子中含有2种官能团
B.可与乙醇、乙酸反应,且反应类型相同
C.1 mol分枝酸分子中含2mol﹣OH(羟基)
D.可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:NOx能与Na2O2反应;NO和NO2均能与酸性KMnO4溶液反应生成NO3ˉ和Mn2+。
I.用下图所示装置(略去夹持仪器)可制得少量亚硝酸钠(2NO+Na2O2=2NaNO2)。

(1)B、D的仪器名称是________,D的作用是________。
(2)通NO前,需先通一段时间N2,目的是________,
(3)E中主要反应的离子方程式为________,
(4)常温下,测得实验前后C的质量差值为0.30g,则制得NaNO2________g。
Ⅱ.NO2和Na2O2都有较强氧化性,为探究NO2与Na2O2反应的产物,提出如下假设:
假设i.NO2氧化Na2O2;假设ii.Na2O2氧化NO2。
甲同学设计如图所示实验装置:

请回答下列问题:
(5)单向阀在实现气体单向流通的同时,还有一个作用是___________。
(6)待试管G中收集满气体,向试管G中加入适量Na2O2粉末,塞紧塞子,轻轻振荡试管内粉末,观察到红棕色气体迅速消失;再将带火星的木条迅速伸进试管内,木条复燃,甲同学据此认为假设i正确。乙同学认为该装置不能达到实验目的,为达到实验目的,应在F、G之间增加一个M装置,M中应盛装__________(可供选择的试剂:碱石灰,浓硫酸饱和氯化钠溶液);乙同学用改进后的装置,重复了甲同学的实验操作,观察到红棕色气体迅速消失,带火星的木条未复燃。得到结论:假设ⅱ正确。
请做出正确判断,写出NO2和Na2O2反应的化学方程式__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《战争的气体化学和分析》中介绍了一种制取COC12(光气,熔点为-118℃,沸点为8.2℃,微溶于水,易溶于甲苯等有机溶剂)的方法,其实验装置如图所示(夹持装置已省略)。已知:3CCl4+2H2SO4(浓) ![]() 3COCl2↑+4HCl+ S2O5Cl2。下列说法正确的是
3COCl2↑+4HCl+ S2O5Cl2。下列说法正确的是

A. 该反应属于氧化还原反应
B. 自来水从冷凝管的X口通入,且被冷凝的物质是CCl4
C. 可将装置丁的尾气通过导管直接通入NaOH溶液中进行尾气处理
D. 装置乙中可收集到光气的甲苯溶液,装置丙、丁均可收集到液态光气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近两年流行喝果醋,苹果醋是一种由苹果发酵而成的具有解毒、降脂、减肥和止泻等明显药效的健康食品。苹果酸(α-羟基丁二酸)是这种饮料的主要酸性物质,苹果酸的结构简式为![]() ,下列说法不正确的是
,下列说法不正确的是
A. 苹果酸在一定条件下能发生酯化反应
B. 苹果酸在一定条件下能发生催化氧化反应
C. 苹果酸在一定条件下能发生取代反应
D. 1 mol苹果酸与Na2CO3溶液反应最多消耗1 mol Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有如下的可逆反应:X(g)+2Y(g)![]() 2Z(g) 现将X和Y以1︰2的体积比混合在密闭容器中,加压到3×107Pa,达到平衡后,已知平衡状态时反应物的总物质的量和生成物的总物质的量相等时,对应图中坐标上的温度是( )
2Z(g) 现将X和Y以1︰2的体积比混合在密闭容器中,加压到3×107Pa,达到平衡后,已知平衡状态时反应物的总物质的量和生成物的总物质的量相等时,对应图中坐标上的温度是( )
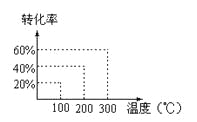
A. 100℃
B. 200℃
C. 300℃
D. 不能确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产需要大量原料,消耗大量能源,在得到所需产品同时产生了大量废气、废水、废渣。某工厂排放的废水中含有Cu2+、Fe2+、Hg2+、H+等离子,某化学小组为了充分利用资源和保护环境,准备回收废水中的铜和汞,同时得到绿矾。他们设计了如下实验方案:

(1)现有仪器:酒精灯、玻璃棒、坩埚、蒸发皿、蒸馏烧瓶、烧杯、铁架台等,完成步骤Ⅳ的实验操作还需要选择的玻璃仪器是__________设计简单实验检验绿矾是否变质,简述你的操作:__________。
(2)步骤Ⅰ中加入过量铁粉的目的是__________,步骤Ⅱ中__________(填“能”或“不能”)用盐酸代替硫酸。
(3)步骤V利用氧化铜制取铜有如下四种方案:
方案甲:利用氢气还原氧化铜;
方案乙:利用一氧化碳还原氧化铜;
方案丙:利用炭粉还原氧化铜;
方案丁:先将氧化铜溶于稀硫酸,然后加入过量的铁粉、过滤,再将滤渣溶于过量的稀硫酸,再过滤、洗涤、烘干。
从安全角度考虑,方案__________不好;从产品纯度考虑,方案__________不好。
(4)写出步骤Ⅱ中涉及反应的离子方程式:__________;步骤Ⅳ得到绿矾的操作蒸发浓缩__________、__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于阿伏加德罗常数的叙述错误的是
A.物质的量越大,阿伏加德罗常数就越大
B.1mol任何粒子的数目都约等于6.02×1023
C.符号为NA,通常用6.02×1023mol-1表示
D.在数值上等于12g12C中所含的碳原子数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com