
【题目】下列关于阿伏加德罗常数的叙述错误的是
A.物质的量越大,阿伏加德罗常数就越大
B.1mol任何粒子的数目都约等于6.02×1023
C.符号为NA,通常用6.02×1023mol-1表示
D.在数值上等于12g12C中所含的碳原子数
 新编小学单元自测题系列答案
新编小学单元自测题系列答案科目:高中化学 来源: 题型:
【题目】某羧酸衍生物A,其分子式为C6H12O2 , 实验表明A和氢氧化钠溶液共热生成B和C,B和盐酸反应生成有机物D,C在铜催化和加热的条件下氧化为E,其中D、E都不能发生银镜反应.由此判断A的可能的结构有( )
A.6种
B.2种
C.4种
D.3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高氯酸铜易溶于水,在130℃时会发生分解反应是一种燃烧催化剂,以食盐等为原料制备高氯酸铜[Cu(ClC4)2·6H2O)]的一种工艺凯程如下:
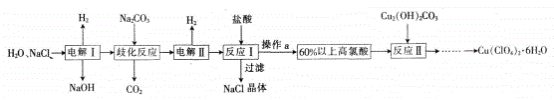
回答下列问题:
(1)发生“电解I”时所用的交换膜是______(填“阳离子交换膜”或“阴离子交换膜”)。
(2)改化反应是同一种物质中同种元素自身的氧化还原反应,已知上述工艺流程中“歧化反应”的产物之一为NaClO3。
①“歧化反应”的化学方程式为_____________。
②“歧化反应”阶段所采用的不同温度对产率影响的结果如图所示。则该反应最适宜的温度是________。

(3)“电解Ⅱ”的阳极产物为________ (填离子符号)。
(4)操作a的名称是______,该流程中可循环利用的物质是________(填化学式)。
(5)用该工艺流程制备高氯酸铜时,若起始时NaCl的质量为a t。最终制得的Cu(ClO4)2·6H2O为bt,则产率为_______(用含a、b的代数式表示)。
(6)某温度下,高氯酸铜控制在A、B的种方式同时分解,分解过程中铜的化合价不发生改变。A方式为Cu(ClO4)2![]() CuCl2+4O2↑,若4 mol高氯酸铜在该温度下按A、B各占50%的方式完全分解,且A、B两种方式转移的电子数之比为8:7,则B方式为________(用化学方程式表示)。
CuCl2+4O2↑,若4 mol高氯酸铜在该温度下按A、B各占50%的方式完全分解,且A、B两种方式转移的电子数之比为8:7,则B方式为________(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学一一有机化学基础]新泽茉莉醛是一种名贵的香料,其合成路线如下:
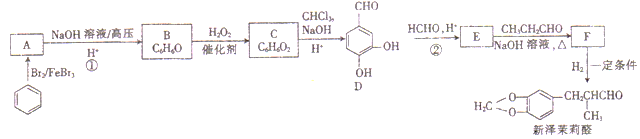
已知:
Ⅰ. ![]()
Ⅱ. 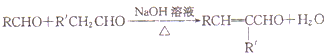
(1)A的化学名称是_____________。
(2)新泽茉莉醛中官能团的名称是_____________。
(3)反应①的反应类型是_____________。
(4)写出反应②的化学方程式:_____________。
(5)芳香族化合物G与E互为同分异构体,1molG能与足量NaHCO3溶液反应产生1mol气体,且G能发生银镜反应,则G的结构有_____种。其中一种结构苯环上的一氯代物有两种,且被氧化后能与乙二醇反应生成高分子化合物,写出该高分子化合物的结构简式:_____________。
(6)结合已知Ⅱ,设计以乙醇和苯甲醛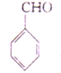 为原料(无机试剂任选)制备
为原料(无机试剂任选)制备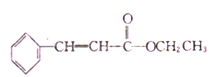 的合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件):_____________。
的合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件):_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是原子序数依次增大的四种短周期元素,m、n、p、q、s是由这些元素中的两种或三种元素组成的化合物,r是由元素C形成的单质,上述物质的转化关系如图所示。常温下0.01 mol·L-1s溶液的pH为12。下列说法正确的是

A. 原子半径的大小B<C<D
B. 化合物n与s中均既含有离子键,又含有共价键
C. 1L0.1mol·L-1的q溶液中阴离子总数等于0.1NA
D. 1mol n与足量的p完全反应可生成11.2L的r
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
汽车尾气中的氮氧化物气体是导致雾霾的要原因之一。请回答下列有关尾气治理的问题:
(1)用化学方程式解释汽车尾气中含有NO的原因_______________________________。
(2)汽车排气管内安装的催化转化器,可使汽车尾气中的主要污染物NO、CO转化为无毒的大气循环物质。
已知:N2(g)+O2(g)=2NO(g) △H=+180.5kJmol-1
2C(s)+O2(g)=2CO(g) △H= -221.0kJmol-1
C(s)+O2(g)=CO2(g) △H= -393.5 kJmol-1
则分析反应2NO(g)+2CO(g)=N2(g)+2CO2(g)的△H= ___________kJmol-1。
(3)将0.20mol NO和0.10molCO充入一个容积恒定为1L的密闭容器中,在不同条件下反应过程中部分物质的浓度变化状况如图1所示。
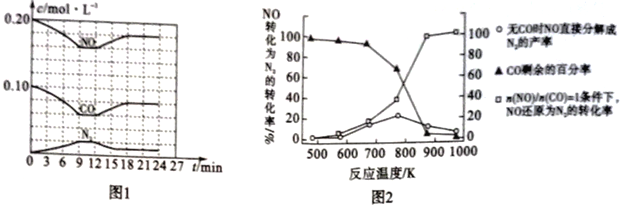
①计算反应在第9-12 min时的平衡常数K=____________。
②第12 min时改变的反应条件可能是_____________(任写一条)。
(4)某研究机构在实验室以Ag-ZSM-5为催化剂。测得单位时间内NO转化为N2的转化率随温度变化情况如图2所示。
①若不使用CO,发现当温度超过775 K时,NO的分解率降低,其可能的原因是________________。
②在n(NO)/n(CO) =1的条件下,为更好地除去NO,应控制的最佳温度应在____ K左右。
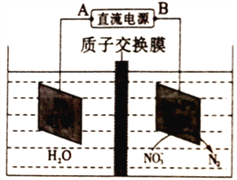
(5)氮氧化物进入水体可转化为NO3-,电化学降解法可用于治理水中NO3-的污染,原理如右图所示。则电源正极为______(选填“A”或“B”),阴极电极反应式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸乙酯是一种非常重要的有机化工原料,可用作生产波萝、香蕉、草莓等水果香精和威士忌、奶油等香料的原料,用途十分广泛。在实验室我们也可以用如图所示的装置制取乙酸乙酯。
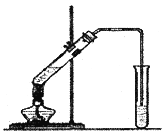
回答下列问题:
(1)乙醇、乙酸分子中的官能团名称分别是_____、______。
(2)下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有______(填序号)。
①单位时间里,生成lmol乙酸乙能,同时生成lmol水
②单位时间里,生成lmol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗lmol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化
(3)下图是分离操作步骤流程图,其中a所用的试剂是______,②的操作是______。
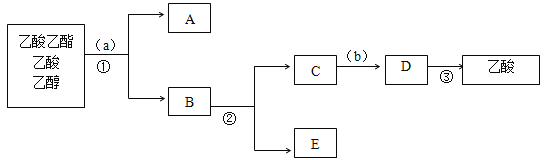
(4)184g乙醇和120g乙酸反应生成106g的乙酸乙酯,则该反应的产率是_____(保留三位有效数字)。
(5)比乙酸乙酯相对分子质量大14的酯有_____种结构。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取1.43 g Na2CO3·xH2O 溶于水配成10 mL 溶液,然后逐滴滴入稀盐酸直至没有气体放出为止,用去盐酸 2.0 mL,并收集到112 mL CO2(标准状况)。
(1)Na2CO3·xH2O的摩尔质量为。
(2)稀盐酸物质的量浓度为。
(3)x值为 , 碳酸钠溶液的物质的量浓度为。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com