
【题目】乙酸乙酯是一种非常重要的有机化工原料,可用作生产波萝、香蕉、草莓等水果香精和威士忌、奶油等香料的原料,用途十分广泛。在实验室我们也可以用如图所示的装置制取乙酸乙酯。
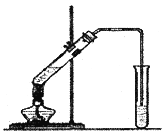
回答下列问题:
(1)乙醇、乙酸分子中的官能团名称分别是_____、______。
(2)下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有______(填序号)。
①单位时间里,生成lmol乙酸乙能,同时生成lmol水
②单位时间里,生成lmol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗lmol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化
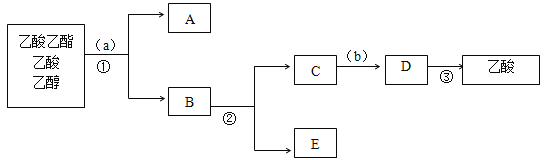
(3)下图是分离操作步骤流程图,其中a所用的试剂是______,②的操作是______。
(4)184g乙醇和120g乙酸反应生成106g的乙酸乙酯,则该反应的产率是_____(保留三位有效数字)。
(5)比乙酸乙酯相对分子质量大14的酯有_____种结构。
【答案】 羟基 羧基 ②④⑤ 饱和Na2CO3溶液 蒸馏 60.2% 9
【解析】(1)根据官能团的结构分析判断;
(2)根据化学平衡状态的特征分析解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变;
(3)根据乙酸乙酯与乙醇、乙酸的性质的差别,结合分离和提纯的原则分析解答;
(4)根据方程式CH3COOH+CH3CH2OH![]() CH3COOC2H5+H2O进行计算即可;
CH3COOC2H5+H2O进行计算即可;
(5)乙酸乙酯的分子式为C4H8O2,比乙酸乙酯相对分子质量大14的酯的分子式为C5H10O2,根据酯的结构分析解答。
(1)醇的官能团为羟基,乙醇中含有的官能团是羟基;羧酸的官能团是羧基,故乙酸中含有的官能团是羧基,故答案为:羟基;羧基;
(2)①单位时间里,生成1mol乙酸乙酯,同时生成1mol水,反应都体现正反应方向,未体现正与逆的关系,故不选;②单位时间里,生成1mol乙酸乙酯,等效消耗1mol乙酸,同时生成1mol乙酸,正逆反应速率相等,故选;③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸,只要反应发生就符合这一关系,故不选;④正反应的速率与逆反应的速率相等,达平衡状态,故选;⑤混合物中各物质的浓度不再变化,说明正反应的速率与逆反应的速率相等,达平衡状态,故选;②④⑤。
(3)加入饱和碳酸钠溶液a,溶解乙醇和乙酸反应生成醋酸钠溶液,乙酸乙酯在碳酸钠溶液中不溶分层分液后将乙酸乙酯分离出来,蒸馏混合溶液分离出乙醇,然后向剩余混合液中加入稀硫酸b,稀硫酸与醋酸钠反应生成醋酸和硫酸钠混合溶液,蒸馏将醋酸分离出来,故答案为:饱和碳酸钠;蒸馏;
(4)n(CH3COOH)=![]() =2mol n(C2H5OH)=
=2mol n(C2H5OH)=![]() =4mol,所以乙醇过量,应以乙酸计算,2mol乙酸完全酯化可生成乙酸乙酯2mol×88g/mol=176g,故该反应的产率为:
=4mol,所以乙醇过量,应以乙酸计算,2mol乙酸完全酯化可生成乙酸乙酯2mol×88g/mol=176g,故该反应的产率为:![]() ×100%=60.2%,故答案为:60.2%.
×100%=60.2%,故答案为:60.2%.
(5) 乙酸乙酯的分子式为C4H8O2,比乙酸乙酯相对分子质量大14的酯的分子式为C5H10O2,结构中含有—COO—,因为—C4H9有4种,则HCOO C4H9有4种;因为—C3H7有2种,则CH3COO C3H7有2种;CH3CH2COOCH2CH3;因为—C3H7有2种,则C3H7COO CH3有2种; 共9种,故答案为:9。


科目:高中化学 来源: 题型:
【题目】《战争的气体化学和分析》中介绍了一种制取COC12(光气,熔点为-118℃,沸点为8.2℃,微溶于水,易溶于甲苯等有机溶剂)的方法,其实验装置如图所示(夹持装置已省略)。已知:3CCl4+2H2SO4(浓) ![]() 3COCl2↑+4HCl+ S2O5Cl2。下列说法正确的是
3COCl2↑+4HCl+ S2O5Cl2。下列说法正确的是

A. 该反应属于氧化还原反应
B. 自来水从冷凝管的X口通入,且被冷凝的物质是CCl4
C. 可将装置丁的尾气通过导管直接通入NaOH溶液中进行尾气处理
D. 装置乙中可收集到光气的甲苯溶液,装置丙、丁均可收集到液态光气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于阿伏加德罗常数的叙述错误的是
A.物质的量越大,阿伏加德罗常数就越大
B.1mol任何粒子的数目都约等于6.02×1023
C.符号为NA,通常用6.02×1023mol-1表示
D.在数值上等于12g12C中所含的碳原子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学用语使用正确的是
A. 硫原子的原子结构示意图: 
B. 原子核内有10个中子的氧原子:![]()
C. NH4Cl的电子式:  .
.
D. 次氯酸的结构式:H-Cl-O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应A2(g)+B2(g)═2AB(s)的能量变化如图所示,判断下列叙述中错误的是( )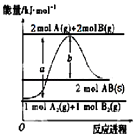
A.该反应热△H=+(a﹣b)kJmol﹣1
B.AB(g)═A(g)+B(g)△H=+b/2kJmol﹣1
C.断裂1 mol A﹣A键和1 mol B﹣B键,吸收a kJ能量
D.该反应在任何条件下都不可能自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A是农药生产中的一种中间体,结构简式为 ,下列叙述中正确的是()
,下列叙述中正确的是()
A. 1molA最多能与4mol H2发生加成反应
B. 1mol A与足量的NaOH溶液反应,消耗NaOH的物质的量为2mol
C. 有机物A与浓硫酸混合加热,可以发生消去反应
D. 有机物A可以在一定条件下与HBr发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g)CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= .
(2)该反应为反应(选填吸热、放热).
(3)某温度下,平衡浓度符合下式:c(CO2)c(H2)=c(CO)c(H2O),试判断此时的温度为℃.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组通过铁与盐酸反应的实验,研究影响反应速率的因素(铁的质量相等,铁块的形状一样,盐酸均过量),设计实验如下表:
实验编号 | 盐酸浓度/(mol/L) | 铁的形态 | 温度/K |
1 | 4.00 | 块状 | 293 |
2 | 4.00 | 粉末 | 293 |
3 | 2.00 | 块状 | 293 |
4 | 2.00 | 粉末 | 313 |
(1)若四组实验均反应进行1分钟(铁有剩余),则以上实验需要测出的数据是______。
(2)实验___和_____(填实验编号)是研究盐酸的浓度对该反应速率的影响;实验1和2是研究_______对该反应速率的影响。
(3)测定在不同时间产生氢气体积V的数据,绘制出图甲,则曲线c、d分别对应的实验组别可能是______、______。

(4)分析其中一组实验,发现产生氢气的速率随时间变化情况如图乙所示。
①其中t1~t2速率变化的主要原因是______。
②t2~t3速率变化的主要原因是___________ 。
(5)实验1产生氢气的体积如丙中的曲线a,添加某试剂能使曲线a变为曲线b的是______。
A.CuO粉末 B.NaNO3固体 C.NaCl溶液 D.浓H2SO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com