
【题目】下列有关化学用语使用正确的是
A. 硫原子的原子结构示意图: 
B. 原子核内有10个中子的氧原子:![]()
C. NH4Cl的电子式:  .
.
D. 次氯酸的结构式:H-Cl-O
科目:高中化学 来源: 题型:
【题目】已知:苯和卤代烃在催化剂的作用下可以生成烷基苯和卤化氢,C是生活中常见的有机物,75%的C溶液可用于医用消毒,乙苯能被酸性高锰酸钾溶液氧化为苯甲酸.几种物质之间的转化关系如图所示(生成物中所有无机物均已略去).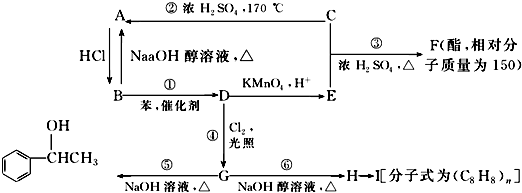
请回答下列问题:
(1)写出物质的结构简式:D;I .
(2)在①~⑥6个反应中,属于消去反应的是(填编号).
(3)写出下列反应的化学方程式:
①;
⑤;
(4)写出一种符合下列要求的F的同分异构体的结构简式:F的同分异构体中属于酯类,能发生银镜反应,且苯环上的一氯取代物只有两种: .
查看答案和解析>>
科目:高中化学 来源: 题型:
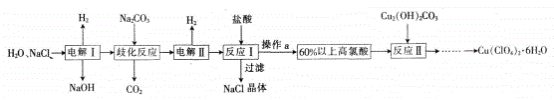
【题目】高氯酸铜易溶于水,在130℃时会发生分解反应是一种燃烧催化剂,以食盐等为原料制备高氯酸铜[Cu(ClC4)2·6H2O)]的一种工艺凯程如下:
回答下列问题:
(1)发生“电解I”时所用的交换膜是______(填“阳离子交换膜”或“阴离子交换膜”)。
(2)改化反应是同一种物质中同种元素自身的氧化还原反应,已知上述工艺流程中“歧化反应”的产物之一为NaClO3。
①“歧化反应”的化学方程式为_____________。
②“歧化反应”阶段所采用的不同温度对产率影响的结果如图所示。则该反应最适宜的温度是________。

(3)“电解Ⅱ”的阳极产物为________ (填离子符号)。
(4)操作a的名称是______,该流程中可循环利用的物质是________(填化学式)。
(5)用该工艺流程制备高氯酸铜时,若起始时NaCl的质量为a t。最终制得的Cu(ClO4)2·6H2O为bt,则产率为_______(用含a、b的代数式表示)。
(6)某温度下,高氯酸铜控制在A、B的种方式同时分解,分解过程中铜的化合价不发生改变。A方式为Cu(ClO4)2![]() CuCl2+4O2↑,若4 mol高氯酸铜在该温度下按A、B各占50%的方式完全分解,且A、B两种方式转移的电子数之比为8:7,则B方式为________(用化学方程式表示)。
CuCl2+4O2↑,若4 mol高氯酸铜在该温度下按A、B各占50%的方式完全分解,且A、B两种方式转移的电子数之比为8:7,则B方式为________(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是原子序数依次增大的四种短周期元素,m、n、p、q、s是由这些元素中的两种或三种元素组成的化合物,r是由元素C形成的单质,上述物质的转化关系如图所示。常温下0.01 mol·L-1s溶液的pH为12。下列说法正确的是

A. 原子半径的大小B<C<D
B. 化合物n与s中均既含有离子键,又含有共价键
C. 1L0.1mol·L-1的q溶液中阴离子总数等于0.1NA
D. 1mol n与足量的p完全反应可生成11.2L的r
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
汽车尾气中的氮氧化物气体是导致雾霾的要原因之一。请回答下列有关尾气治理的问题:
(1)用化学方程式解释汽车尾气中含有NO的原因_______________________________。
(2)汽车排气管内安装的催化转化器,可使汽车尾气中的主要污染物NO、CO转化为无毒的大气循环物质。
已知:N2(g)+O2(g)=2NO(g) △H=+180.5kJmol-1
2C(s)+O2(g)=2CO(g) △H= -221.0kJmol-1
C(s)+O2(g)=CO2(g) △H= -393.5 kJmol-1
则分析反应2NO(g)+2CO(g)=N2(g)+2CO2(g)的△H= ___________kJmol-1。
(3)将0.20mol NO和0.10molCO充入一个容积恒定为1L的密闭容器中,在不同条件下反应过程中部分物质的浓度变化状况如图1所示。
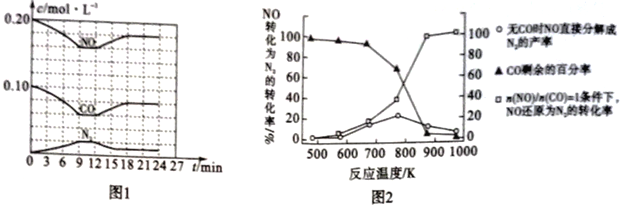
①计算反应在第9-12 min时的平衡常数K=____________。
②第12 min时改变的反应条件可能是_____________(任写一条)。
(4)某研究机构在实验室以Ag-ZSM-5为催化剂。测得单位时间内NO转化为N2的转化率随温度变化情况如图2所示。
①若不使用CO,发现当温度超过775 K时,NO的分解率降低,其可能的原因是________________。
②在n(NO)/n(CO) =1的条件下,为更好地除去NO,应控制的最佳温度应在____ K左右。
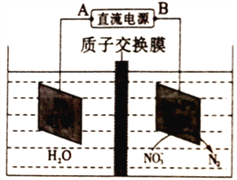
(5)氮氧化物进入水体可转化为NO3-,电化学降解法可用于治理水中NO3-的污染,原理如右图所示。则电源正极为______(选填“A”或“B”),阴极电极反应式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用乙醇与浓硫酸来制取乙烯,反应装置如下图A所示,发生反应为CH3CH2OH ![]() CH2=CH2↑+H2O
CH2=CH2↑+H2O

请回答下列问题:
Ⅰ.制取实验中,混合乙醇与浓硫酸的操作是_________,通常在圆底烧瓶中加入几粒碎瓷片的作用是_________________,装置A图中一处明显的错误是____________________。
Ⅱ.用该方法在实验室制取乙烯时,常会看到烧瓶中液体变黑,并使装置A中制得的乙烯中混有CO2、SO2等杂质气体。为确定乙烯及各种杂质气体的存在,请用上面给出的实验装置完成下面的实验探究设计。
探究设计1:若要检验A中所得气体含有SO2,可将混合气体直接通入__________(填装置代号,下同)装置;若要检验A中所得气体含有乙烯,可将混合气体直接通入____________________。
探究设计2:若将A中所得气体依次通过①→②→③→E装置,根据实验现象可确定乙烯气体中混有二氧化硫气体。
则:(1)设计2中①→②→③装置对应的装置分别是___________________(填装置代号)。
(2)设计2中能说明二氧化硫气体存在的现象是___________________________。
(3)使用装置②的目的是____________________。使用装置③的目的是________________________。
(4)设计2中确认乙烯气体存在的现象是_____________________。
探究设计3:若要一次性将乙烯、CO2、SO2三种气体全部检验出来,气体被检验出来的先后顺序是___________________,气体通过装置的顺序为A→______(填装置代号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸乙酯是一种非常重要的有机化工原料,可用作生产波萝、香蕉、草莓等水果香精和威士忌、奶油等香料的原料,用途十分广泛。在实验室我们也可以用如图所示的装置制取乙酸乙酯。
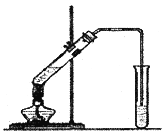
回答下列问题:
(1)乙醇、乙酸分子中的官能团名称分别是_____、______。
(2)下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有______(填序号)。
①单位时间里,生成lmol乙酸乙能,同时生成lmol水
②单位时间里,生成lmol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗lmol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化
(3)下图是分离操作步骤流程图,其中a所用的试剂是______,②的操作是______。
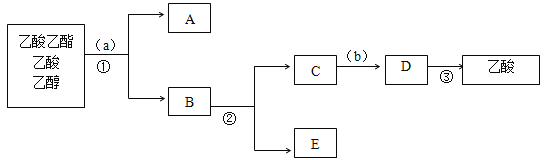
(4)184g乙醇和120g乙酸反应生成106g的乙酸乙酯,则该反应的产率是_____(保留三位有效数字)。
(5)比乙酸乙酯相对分子质量大14的酯有_____种结构。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应C(s)+H2O(g)CO(g)+H2(g)在一密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
A.增加C的量
B.将容器的体积缩小一半
C.保持容器体积不变,充入N2
D.保持容器体积不变,充入H2O(g)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com