
【题目】镁、铝分别与等浓度等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)的关系如图所示,则下列关于反应中镁和铝的叙述正确的是
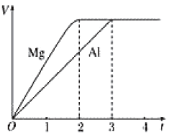
A.二者物质的量之比为3:2
B.二者质量之比为2:3
C.二者分别与足量的氢氧化钠溶液,产生气体体积仍然相等
D.二者消耗H2SO4的物质的量之比为2:3
科目:高中化学 来源: 题型:
【题目】A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如下(部分反应中的水已略去)。根据题意回答下列问题:
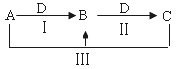
(1)若A、B、C的焰色反应均为黄色,C为厨房中的用品,D的过度排放会造成温室效应。
①A的化学式______________、B的俗名____________;
②反应II的离子方程式是__________________________________。
(2)若A、D均为单质,且A为气体,D元素的一种红棕色氧化物常用作颜料。
①反应II的离子方程式是_____________________________;
②反应Ⅲ的离子方程式是_____________________________;
③检验B中阳离子最好的方法是_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚铁氰化钾晶体化学式为:KxFey(CN)znH2O,俗称黄血盐,常用作食品抗结剂。一种用NaCN(N显-3价)废液制取黄血盐的主要工艺流程:
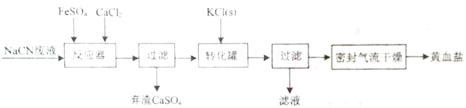
(1)实验室用绿矾固体配制FeSO4溶液时,应先________,再用蒸馏水稀释。
(2)“转化罐”中生成黄血盐晶体的反应类型为________。
(3)采用密封气流干燥取代在通风橱内干燥的原因是________。
(4)黄血盐的化学式可通过下列实验测定:
①准确称取4.220g样品加入水中充分溶解,将所得溶液转移至容量瓶配制成100.00mL溶液A。
②量取25.00mL溶液A,用2.000molL-1KMnO4溶液滴定,达到滴定终点时,共消耗KMnO4溶液15.25mL。反应如下(未配平):![]() ③向②所得溶液加入Mn2+离子交换树脂,将Mn2+完全吸附后再滴加足量NaOH溶液,过滤、洗涤、灼烧,最终得固体0.2g。
③向②所得溶液加入Mn2+离子交换树脂,将Mn2+完全吸附后再滴加足量NaOH溶液,过滤、洗涤、灼烧,最终得固体0.2g。
通过计算确定样品的化学式(写出计算过程)。______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸锰可用于制造钠离子电池的负极材料。可用如下反应制得乙酸锰:4Mn(NO3)2·6H2O+26(CH3CO)2O=4(CH3COO)3Mn +8HNO2+ 3O2↑+40CH3COOH。
(1)Mn3+基态核外电子排布式为____。
(2)NO![]() 的空间构型为___;CH3COOH分子中碳原子的轨道杂化类型为__。
的空间构型为___;CH3COOH分子中碳原子的轨道杂化类型为__。
(3)配合物[Mn(CH3OH)6]2+中配位原子是__。
(4)CH3COOH能与H2O任意比混溶的原因,除它们都是极性分子外还因为___。
(5)MnS晶体具有α、β、γ三种形态,其中β-MnS的晶胞结构如图所示,则Mn2+的配位数为____。
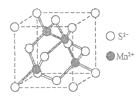
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在恒压绝热容器中发生反应:2SO2(g)+O2(g)![]() 2SO3(g) △H=-197kJ·mol-1下列有关说法正确的是
2SO3(g) △H=-197kJ·mol-1下列有关说法正确的是
A. 达到化学平衡状态时,v正(O2)=2v逆(SO2)
B. 容器内的压强不再变化说明反应达到化学平衡状态
C. 加入0.2 mol SO2和0.1 mol O2,充分反应后放出热量19.7kJ
D. 向容器中充入二氧化硫,正反应速率增大,逆反应速率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂用六水合氯化镁和粗石灰制取的氢氧化镁含有少量氢氧化铁杂质,通过如下流程进行提纯精制,获得阻燃剂氢氧化镁。下列说法不正确的是

A. 步骤②中分离操作的名称是过滤,Mg(OH)2可以作阻燃剂是因为它分解需要吸收大量的热
B. 步骤①中的反应式:3Fe(OH)3 +S2O42-+2OH- =3Fe(OH)2 +2SO42-+4H2O
C. 步骤①中保险粉是作还原剂
D. 从步骤② 中可知OH- 和EDTA共存时,Fe2+更易和EDTA结合,生成可溶性化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、F为金属单质,C是淡黄色粉末,M有磁性,回答下题。
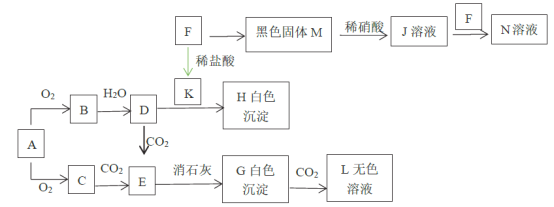
已知:2Na2O2+2CO2=2Na2CO3+O2
(1)写出下列物质的化学式。C____________L_______
(2)用玻璃棒蘸取少量无水CuSO4与熔化的A接触,瞬间产生耀眼的火花,同时有红色物质生成,写出该反应的化学反应方程式__________,在该反应中,氧化剂是____________。
(3)已知氧化性:HNO3>Fe3+,稀硝酸的还原产物是NO,写出固体M与稀硝酸反应的离子方程式________。
(4)写出J与F混合的化学反应方程式:_______。
(5)写出L与足量的D反应的离子方程式:__________。
(6)向1 L 0.2 mol/L的D溶液中通入CO2气体3.36 L(标准状况),所得溶液中的溶质是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() (明矾),在生活、生产等方面应用广泛。实验室中,采用废易拉罐(主要成分为Al,含有少量的Fe、Mg杂质)制备明矾的过程如下图所示。
(明矾),在生活、生产等方面应用广泛。实验室中,采用废易拉罐(主要成分为Al,含有少量的Fe、Mg杂质)制备明矾的过程如下图所示。
![]()
回答下列问题:
(1)试剂①应选用________(填标号)
a.HCl溶液 b.![]() 溶液 c.氨水 d.NaOH溶液
溶液 c.氨水 d.NaOH溶液
写出有关反应的化学方程式________________________________。
(2)沉淀B的化学式为________,将少量明矾溶于水,溶液呈弱酸性,用方程式解释其原因________________________________。
(3)如果把废易拉罐先溶于过量的稀硫酸中,再加入过量的NaOH溶液,微热,过滤,得到的沉淀主要是________________________。
(4)在加入反应试剂时,为保证反应充分进行,往往加入的量要稍微过量。在操作2中如何检验沉淀完全,写出检验方法:________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用价电子对互斥理论(VSEPR)可以预测许多分子或离子的空间构型,也可推测键角大小,下列判断正确的是( )
A.BF3与PCl3为三角锥形B.SO3与CO32-为平面三角形
C.SO2键角大于120oD.BF3是三角锥形分子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com