
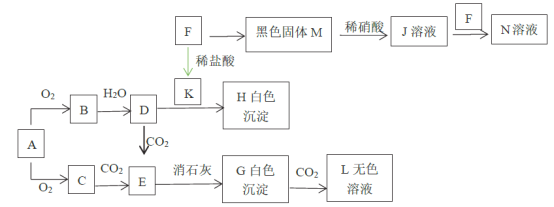
【题目】已知A、F为金属单质,C是淡黄色粉末,M有磁性,回答下题。
已知:2Na2O2+2CO2=2Na2CO3+O2
(1)写出下列物质的化学式。C____________L_______
(2)用玻璃棒蘸取少量无水CuSO4与熔化的A接触,瞬间产生耀眼的火花,同时有红色物质生成,写出该反应的化学反应方程式__________,在该反应中,氧化剂是____________。
(3)已知氧化性:HNO3>Fe3+,稀硝酸的还原产物是NO,写出固体M与稀硝酸反应的离子方程式________。
(4)写出J与F混合的化学反应方程式:_______。
(5)写出L与足量的D反应的离子方程式:__________。
(6)向1 L 0.2 mol/L的D溶液中通入CO2气体3.36 L(标准状况),所得溶液中的溶质是__________。
【答案】Na2O2 Ca(HCO3)2 2Na+ CuSO4=== Cu+ Na2SO4 CuSO4 3Fe3O4+28H++NO3- ===9Fe3++NO↑+14H2O 2FeCl3+ Fe === 3FeCl2 Ca2++ 2HCO3-+ 2OH- === CaCO3↓+ CO32- +2H2O Na2CO3、NaHCO3
【解析】
A为金属单质,与O2生成的C是淡黄色粉末,可推断A为Na,C为Na2O2,根据已知:2Na2O2+2CO2=2Na2CO3+O2,可知E为 Na2CO3,白色沉淀G为CaCO3,CaCO3和CO2反应生成的L为Ca(HCO3)2;F为金属单质,M有磁性,可推断F为Fe,M为Fe3O4,K为FeCl2,Fe3O4和HNO3反应生成Fe(NO3)3,Fe(NO3)3和Fe反应生成Fe(NO3)2;由A为Na,C为Na2O2,可推断B为Na2O,D为NaOH,NaOH和FeCl2反应生成的H是Fe(OH)2。可在此推导基础上解各小题。
(1)根据推导结果可知,淡黄色粉末C是Na2O2,CaCO3和CO2反应生成的L为Ca(HCO3)2。答案为:Na2O2;Ca(HCO3)2
(2)A是Na,反应生成的红色物质是Cu,则该反应的化学反应方程式为:2Na+ CuSO4=== Cu+ Na2SO4,Cu元素化合价降低,所以CuSO4是氧化剂。答案为:2Na+ CuSO4=== Cu+ Na2SO4;CuSO4
(3)M是Fe3O4,可表示为FeOFe2O3,+2价Fe和+3价Fe个数比为1:2;根据已知,氧化性:HNO3>Fe3+,可知+2的Fe能被稀硝酸氧化为Fe3+并失去1个电子;还原产物是NO得到3个电子,根据电子守恒,Fe3O4和NO应为3:1,再根据电荷守恒、质量守恒,可写出固体M与稀硝酸反应的离子方程式为:3Fe3O4+28H+ +NO3- ===9Fe3+ + NO↑+14H2O。答案为:3Fe3O4+28H+ +NO3- === 9Fe3+ +NO↑+14H2O
(4)J是FeCl3,F是Fe,二者混合反应生成FeCl2,化学反应方程式为:2FeCl3+ Fe === 3FeCl2。答案为:2FeCl3+ Fe === 3FeCl2
(5)L是Ca(HCO3)2,D是NaOH,二者反应可理解为:先HCO3- + OH- === CO32- + H2O,继而Ca2++ CO32- === CaCO3↓;由于NaOH足量,所以Ca(HCO3)2完全反应,即,参加反应的Ca2+和HCO3-比值为1:2,则该反应的离子方程式为:Ca2++ 2HCO3- + 2OH- === CaCO3 ↓+ CO32- +2H2O。答案为:Ca2++ 2HCO3- + 2OH- === CaCO3↓+ CO32- +2H2O
(6)D(NaOH)的物质的量为1 L×0.2 mol/L=
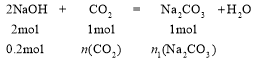
n(CO2)= 0.1 mol,n1(Na2CO3) = 0.1 mol,
再:
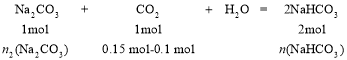
n2(Na2CO3)= 0.05 mol,n(NaHCO3)= 0.1 mol
Na2CO3剩余0.1 mol-0.05 mol=0.05 mol,所以所得溶液中的溶质是0.05 mol Na2CO3和0.1 mol NaHCO3。答案为:Na2CO3、NaHCO3


科目:高中化学 来源: 题型:
【题目】H2S水溶液中存在电离平衡H2S![]() H++HS-和HS-
H++HS-和HS-![]() H++S2-。若向H2S溶液中
H++S2-。若向H2S溶液中
A.加水,平衡向右移动,溶液中氢离子浓度增大
B.通入过量SO2气体,平衡向左移动,溶液pH值增大
C.滴加新制氯水,平衡向左移动,溶液pH值减小
D.加入少量硫酸铜固体(忽略体积变化),溶液中所有离子浓度都减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示为石蜡油分解的实验装置。在试管①中加入石蜡油和氧化铝;试管②放在冷水中;试管③中加入酸性高锰酸钾溶液;试管④中加入溴水。分析实验完成下列各题:
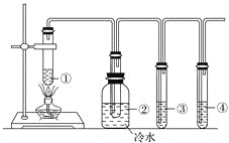
分析实验回答下列问题:
(1)试管①中加入氧化铝的作用是____________________________________________。
(2)试管②内看到的实验现象是______________________________________________。
(3)试管③中看到的实验现象为_______________________________________________,发生________反应(填反应类型)。
(4)试管④中看到的实验现象为_______________________________________________,发生________反应(填反应类型)。
(5)通过本实验说明______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁、铝分别与等浓度等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)的关系如图所示,则下列关于反应中镁和铝的叙述正确的是
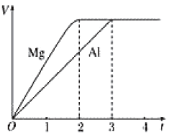
A.二者物质的量之比为3:2
B.二者质量之比为2:3
C.二者分别与足量的氢氧化钠溶液,产生气体体积仍然相等
D.二者消耗H2SO4的物质的量之比为2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某离子反应涉及H2O、Cr2O72-、NO2-、H+、NO3-、Cr3+六种微粒,已知反应过程中NO2-浓度变化如图所示,下列说法不正确的是
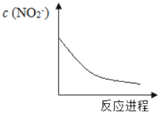
A.随着反应的进行,溶液中的H+浓度减小B.反应的氧化剂是NO3-
C.消耗1 mol氧化剂,转移电子6NAD.氧化性:Cr2O72->NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸铜[(CH3COO)2Cu·H2O](其相对式量为200)常用作分析化学的分析试剂,还用作有机合成催化剂、瓷釉颜料等。可以用碱式碳酸铜与醋酸作用来制备。
实验步骤:
(I)碱式碳酸铜的制备

(Ⅱ)醋酸铜的制备
碱式碳酸铜与醋酸反应制得醋酸铜:
Cu(OH)2·CuCO3+4CH3COOH=2(CH3COO)2Cu·H2O+CO2↑+H2O
将产品碱式碳酸铜放入烧杯内,加入约20mL蒸馏水,加热搅拌至323K左右,逐滴加入适量醋酸至固体不再溶解,趁热过滤。滤液在通风橱下蒸发至原体积的![]() 左右,冷却至室温,减压过滤,用少量蒸馏水洗涤,得(CH3COO)2Cu·H2O产品,称量,计算产率。
左右,冷却至室温,减压过滤,用少量蒸馏水洗涤,得(CH3COO)2Cu·H2O产品,称量,计算产率。
回答下列问题:
(1)步骤(ⅰ)将研磨后混合物注入热水中反应,写出离子反应方程式______。
(2)碱式碳酸铜的制备需在热水中进行反应,且温度需控制在60℃左右,请解释原因______。
(3)在步骤(ⅰ)与步骤(ⅱ)的实验过程中,涉及三种固液分离的方法,分别是倾析法过滤、趁热过滤与减压过滤,下列装置中没有使用到的有______。
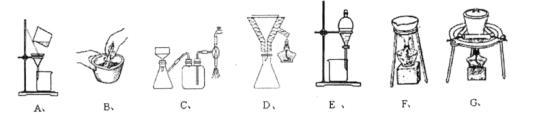
(4)步骤ⅱ中洗涤晶体的具体操作是______。
(5)最终称量所得的产品为8.0g,则产率为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在200ml含Mg2+、Al3+、NH4+、H+、Cl-的溶液中,逐滴加入5mol/L的NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示。下列叙述不正确的是

A. x-y=0.01mol B. 原溶液中c(Cl-)=0.75mol·L-1
C. 原溶液的pH=1 D. 原溶液中n(Mg2+):n(Al3+)=5:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按照如图所示的操作步骤,完成铝与盐酸反应的实验。
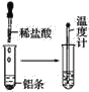
回答下列问题:
(1)实验过程中观察到的实验现象是__。
(2)写出铝与盐酸反应的离子方程式__。
(3)该反应是放热反应还是吸热反应__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物Z是制备药物的中间体,合成Z的路线如下图所示,下列有关叙述不正确的是
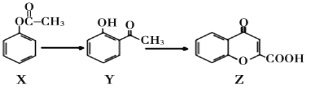
A. X的分子式为C8H8O2
B. X、Y、Z均能和NaOH溶液反应
C. 可用NaHCO3溶液鉴别Y和Z
D. 1mol X跟足量H2反应,最多消耗4mol H2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com