
【题目】醋酸铜[(CH3COO)2Cu·H2O](其相对式量为200)常用作分析化学的分析试剂,还用作有机合成催化剂、瓷釉颜料等。可以用碱式碳酸铜与醋酸作用来制备。
实验步骤:
(I)碱式碳酸铜的制备

(Ⅱ)醋酸铜的制备
碱式碳酸铜与醋酸反应制得醋酸铜:
Cu(OH)2·CuCO3+4CH3COOH=2(CH3COO)2Cu·H2O+CO2↑+H2O
将产品碱式碳酸铜放入烧杯内,加入约20mL蒸馏水,加热搅拌至323K左右,逐滴加入适量醋酸至固体不再溶解,趁热过滤。滤液在通风橱下蒸发至原体积的![]() 左右,冷却至室温,减压过滤,用少量蒸馏水洗涤,得(CH3COO)2Cu·H2O产品,称量,计算产率。
左右,冷却至室温,减压过滤,用少量蒸馏水洗涤,得(CH3COO)2Cu·H2O产品,称量,计算产率。
回答下列问题:
(1)步骤(ⅰ)将研磨后混合物注入热水中反应,写出离子反应方程式______。
(2)碱式碳酸铜的制备需在热水中进行反应,且温度需控制在60℃左右,请解释原因______。
(3)在步骤(ⅰ)与步骤(ⅱ)的实验过程中,涉及三种固液分离的方法,分别是倾析法过滤、趁热过滤与减压过滤,下列装置中没有使用到的有______。
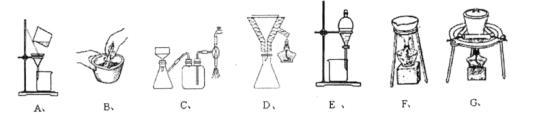
(4)步骤ⅱ中洗涤晶体的具体操作是______。
(5)最终称量所得的产品为8.0g,则产率为______。
【答案】2Cu2++4HCO3-=Cu(OH)2·CuCO3↓+3CO2↑+H2O 升高温度能加快反应,但温度过高导致Cu(OH)2·CuCO3分解 AEG 关小水龙头,向布氏漏斗中加水至浸没晶体,使水缓慢通过晶体重复2-3次 80%
【解析】
(1)步骤(ⅰ)将研磨后混合物注入热水后,会观察到有大量气泡产生并有蓝色沉淀产生,可知除生成Cu(OH)2CuCO3外,还有CO2 气体生成,结合电荷守恒和原子守恒即可写出发生反应的离子方程式;
(2)碱式碳酸铜不稳定,温度过高容易分解;
(3)根据步骤(ⅰ)与步骤(ⅱ)中制备醋酸铜的操作步骤选用需要的仪器;
(4)根据减压过滤操作分析洗涤晶体操作方法;
(5)根据n=![]() 计算出硫酸铜晶体、碳酸氢钠的物质的量,然后根据不足量计算出生成碱式碳酸铜 的物质的量,再根据反应Cu(OH)2CuCO3+4CH3COOH+5H2O=Cu(CH3COO)24H2O+CO2↑计算出理论上生成甲酸铜晶体的质量,最后计算出产率。
计算出硫酸铜晶体、碳酸氢钠的物质的量,然后根据不足量计算出生成碱式碳酸铜 的物质的量,再根据反应Cu(OH)2CuCO3+4CH3COOH+5H2O=Cu(CH3COO)24H2O+CO2↑计算出理论上生成甲酸铜晶体的质量,最后计算出产率。
(1)步骤(ⅰ)将研磨后混合物注入热水后,生成Cu(OH)2CuCO3和CO2,发生反应的离子方程式为2Cu2++4HCO3-=Cu(OH)2CuCO3↓+3CO2↑+H2O;
(2)温度升高能加快反应速率,但温度过高,就会导致Cu(OH)2CuCO3分解,则制备Cu(OH)2CuCO3需在热水中进行反应,且温度需控制在60℃左右;
(3)根据醋酸铜的制备步骤可知,固体研碎应在研钵中进行,倾析法过滤不需要过滤装置A,需要减压过滤需要装置C、趁热过滤需要装置D,和蒸发装置需要装置 F,没有使用到分液装置和固体加热分解装置,则需要的装置有A、E、G;
(4)利用减压抽滤装置洗涤晶体,具体操作是关小水龙头,向布氏漏斗中加水至 浸没晶体,使水缓慢通过晶体重复2-3次;
(5)12.5g硫酸铜晶体的物质的量n(CuSO4)=![]() =0.05mol, 9.5g碳酸氢钠的物质的量n(NaHCO3)=
=0.05mol, 9.5g碳酸氢钠的物质的量n(NaHCO3)=![]() ≈0.113mol, 根据反应2CuSO4+4NaHCO3=Cu(OH)2CuCO3↓+3CO2↑+2Na2SO4 +H2O可知,NaHCO3,反应生成的碱式碳酸铜的物质的量等于硫酸铜晶体的物质的量为0.05mol,根据反应Cu(OH)2CuCO3 +4CH3COOH+5H2O=Cu(CH3COO)24H2O+CO2↑可知,生成甲酸铜的物质的量也为0.05mol, 所以反应产生甲酸铜的产率为:
≈0.113mol, 根据反应2CuSO4+4NaHCO3=Cu(OH)2CuCO3↓+3CO2↑+2Na2SO4 +H2O可知,NaHCO3,反应生成的碱式碳酸铜的物质的量等于硫酸铜晶体的物质的量为0.05mol,根据反应Cu(OH)2CuCO3 +4CH3COOH+5H2O=Cu(CH3COO)24H2O+CO2↑可知,生成甲酸铜的物质的量也为0.05mol, 所以反应产生甲酸铜的产率为:![]() ×0.05mol×100%=80%。
×0.05mol×100%=80%。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】常温下,将pH=1的硫酸溶液平均分成两等份,一份加入适量水,另一份加入与该硫酸溶液物质的量浓度相同的NaOH溶液,两者pH都升高了1。则加入水和加入NaOH溶液的体积比约为( )
A. 11∶1 B. 10∶1 C. 6∶1 D. 5∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H(![]() ),是一种常见的抗结肠炎药物。如图是利用芳香烃A为原料设计制备H的路线。
),是一种常见的抗结肠炎药物。如图是利用芳香烃A为原料设计制备H的路线。
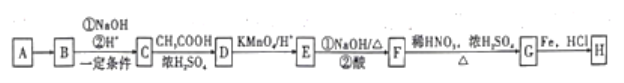
已知:①A蒸气的密度是相同条件下氢气密度的46倍;
②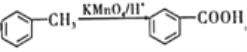 。
。
回答下列问题
(1)A的名称是_______,C中含有官能团的名称是____。
(2)写出C生成D的化学方程式:______,该反应的类型是______。
(3)G的结构简式是______。
(4)设计C→D和E→F两步反应的目的是______。
(5)化合物X是D的同分异构体,符合下列条件的X共______种。
①芳香族化合物,且苯环上有两个取代基②能发生水解反应
写出其中核磁共振氢谱显示有4种不同化学环境的氢原子,峰面积之比为3:3:2:2的所有X的结构简式:______。
(6)已知![]() 易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻、对位,而当苯环上连有羧基时则取代在间位。据此写出以A为原料制备化合物
易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻、对位,而当苯环上连有羧基时则取代在间位。据此写出以A为原料制备化合物![]() 的合成路线(无机试剂任选)___________。
的合成路线(无机试剂任选)___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分子或离子中中心原子价层电子对几何构型为四面体且分子或离子空间的构型为V形的是( )
A. NH4+ B. PH3 C. H3O+ D. OF2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂用六水合氯化镁和粗石灰制取的氢氧化镁含有少量氢氧化铁杂质,通过如下流程进行提纯精制,获得阻燃剂氢氧化镁。下列说法不正确的是

A. 步骤②中分离操作的名称是过滤,Mg(OH)2可以作阻燃剂是因为它分解需要吸收大量的热
B. 步骤①中的反应式:3Fe(OH)3 +S2O42-+2OH- =3Fe(OH)2 +2SO42-+4H2O
C. 步骤①中保险粉是作还原剂
D. 从步骤② 中可知OH- 和EDTA共存时,Fe2+更易和EDTA结合,生成可溶性化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于A2+3B2 ![]() 2C的反应来说,以下化学反应速率的表示中,反应速度最慢的是
2C的反应来说,以下化学反应速率的表示中,反应速度最慢的是
A. v(B2)=0.8 mol/(L·s)B. v(B2)= 3mol/(L·min)
C. v(C)=0.6 mol/(L·s)D. v(A2)=0.4 mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】控制适合的条件,将反应Fe3++AgFe2++Ag+设计成如下图所示的原电池(盐桥装有琼脂-硝酸钾溶液;灵敏电流计的0刻度居中,左右均有刻度)。已知接通后,观察到电流计指针向右偏转。下列判断不正确的是( )。
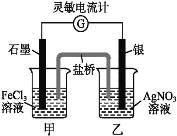
A. 在外电路中,电子从银电极流向石墨电极
B. 盐桥中的K+移向甲烧杯
C. 电流计指针居中后,往甲烧杯中加入一定量的铁粉,电流计指针将向左偏转
D. 一段时间后,电流计指针反向偏转,越过0刻度,向左边偏转
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】偏钒酸铵(NH4VO3)主要用作催化剂、催干剂、媒染剂等。用沉淀法除去工业级偏钒酸铵中的杂质硅、磷的流程如图:
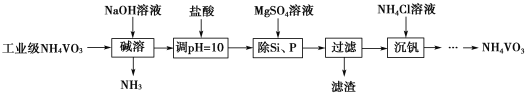
(1)碱溶时,下列措施有利于NH3逸出的是____(填字母序号)。
a.升高温度 b.增大压强 c.增大NaOH溶液的浓度
(2)①滤渣的主要成分为Mg3(PO4)2、MgSiO3,已知Ksp(MgSiO3)=2.4×10-5,若滤液中c(SiO32-)=0.08mol·L-1,则c(Mg2+)=____。
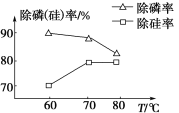
②由图可知,加入一定量的MgSO4溶液作沉淀剂时,随着温度的升高,除磷率下降,其原因是温度升高,Mg3(PO4)2溶解度增大和促进Mg2+水解生成Mg(OH)2;但随着温度的升高,除硅率升高,其原因是____(用离子方程式表示)。
(3)沉钒时,反应温度需控制在50℃,在实验室可采取的加热方式为____。
(4)探究NH4Cl的浓度对沉钒率的影响,设计实验步骤(常见试剂任选):取两份10mL一定浓度的滤液A和B,分别加入1mL和10mL的1mol·L-1 NH4Cl溶液,再向A中加入___mL蒸馏水,控制两份溶液的温度均为50℃、pH均为8,由专用仪器测定沉钒率,加入蒸馏水的目的是____。
(5)偏钒酸铵本身在水中的溶解度不大,但在草酸(H2C2O4)溶液中因发生氧化还原反应而溶解,同时生成络合物(NH4)2[(VO)2(C2O4)3],该反应的化学方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机合成是制药工业中的重要手段。G是某抗炎症药物的中间体,其合成路线如图:
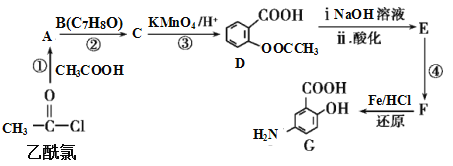
已知:
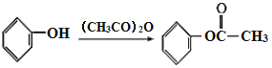 ,
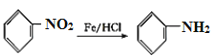
,
(1)B的结构简式为_____。
(2)反应④的条件为____;①的反应类型为___;反应②的作用是____。
(3)下列对有机物G的性质推测正确的是____(填选项字母)。
A.具有两性,既能与酸反应也能与碱反应
B.能发生消去反应、取代反应和氧化反应
C.能聚合成高分子化合物
D.1mol G与足量NaHCO3溶液反应放出2mol CO2
(4)D与足量的NaOH溶液反应的化学方程式为_____。
(5)符合下列条件的C的同分异构体有___种。
A.属于芳香族化合物,且含有两个甲基 B.能发生银镜反应 C.与FeCl3溶液发生显色反应
其中核磁共振氢谱有4组峰,且峰面积之比为6∶2∶1∶1的是___(写出其中一种的结构简式)。
(6)已知:苯环上有烷烃基时,新引入的取代基连在苯环的邻、对位;苯环上有羧基时,新引入的取代基连在苯环的间位。根据题中的信息,写出以甲苯为原料合成有机物![]() 的流程图(无机试剂任选)。_______
的流程图(无机试剂任选)。_______
合成路线流程图示例如图:X![]() Y
Y![]() Z…目标产物
Z…目标产物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com