
【题目】偏钒酸铵(NH4VO3)主要用作催化剂、催干剂、媒染剂等。用沉淀法除去工业级偏钒酸铵中的杂质硅、磷的流程如图:
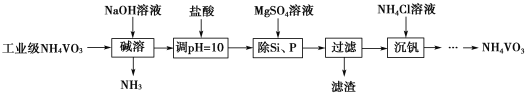
(1)碱溶时,下列措施有利于NH3逸出的是____(填字母序号)。
a.升高温度 b.增大压强 c.增大NaOH溶液的浓度
(2)①滤渣的主要成分为Mg3(PO4)2、MgSiO3,已知Ksp(MgSiO3)=2.4×10-5,若滤液中c(SiO32-)=0.08mol·L-1,则c(Mg2+)=____。
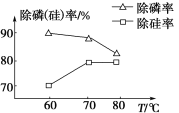
②由图可知,加入一定量的MgSO4溶液作沉淀剂时,随着温度的升高,除磷率下降,其原因是温度升高,Mg3(PO4)2溶解度增大和促进Mg2+水解生成Mg(OH)2;但随着温度的升高,除硅率升高,其原因是____(用离子方程式表示)。
(3)沉钒时,反应温度需控制在50℃,在实验室可采取的加热方式为____。
(4)探究NH4Cl的浓度对沉钒率的影响,设计实验步骤(常见试剂任选):取两份10mL一定浓度的滤液A和B,分别加入1mL和10mL的1mol·L-1 NH4Cl溶液,再向A中加入___mL蒸馏水,控制两份溶液的温度均为50℃、pH均为8,由专用仪器测定沉钒率,加入蒸馏水的目的是____。
(5)偏钒酸铵本身在水中的溶解度不大,但在草酸(H2C2O4)溶液中因发生氧化还原反应而溶解,同时生成络合物(NH4)2[(VO)2(C2O4)3],该反应的化学方程式为____。
【答案】ac 3×10-4mol·L-1 ![]() (或
(或![]() ) 水浴加热 9 使两份溶液总体积相等,确保其他条件相同,而NH4Cl的浓度不同 2NH4VO3+4H2C2O4=(NH4)2[(VO)2(C2O4)3]+2CO2↑+4H2O
) 水浴加热 9 使两份溶液总体积相等,确保其他条件相同,而NH4Cl的浓度不同 2NH4VO3+4H2C2O4=(NH4)2[(VO)2(C2O4)3]+2CO2↑+4H2O
【解析】
工业级钒酸铵先用NaOH溶液溶解,生成NaVO3,再加入盐酸调节溶液的PH=10后加入MgSO4溶液,使Si、P转化为Mg3(PO4)2、MgSiO3沉淀而除去,过滤后滤液中加入NH4Cl溶液,生成NH4VO3。
(1)气体溶解度随温度升高而降低,所以加热可以使NH3逸出。在溶有NH3的溶液中,存在平衡:NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH4++OH-,增大OH-浓度,可以使平衡逆移,也促使NH3逸出;故选ac;
NH4++OH-,增大OH-浓度,可以使平衡逆移,也促使NH3逸出;故选ac;
(2)①滤液中c(SiO32-)=0.08mol·L-1,根据Ksp(MgSiO3)=2.4×10-5,则c(Mg2+)=![]() mol/L;
mol/L;
②温度升高,硅酸根离子水解程度增大,可以成为H2SiO3沉淀从而提高除硅率,离子方程式为![]() (或
(或![]() );
);
(3)温度在100℃以下,可以用水浴加热法,水浴加热不但可以受热均匀,而且温度易于控制,故答案为:水浴加热;
(4)要探究NH4Cl的浓度对沉钒率的影响,一份10mL的滤液A中加入1mL NH4Cl溶液,另一份10mL的滤液B中加入10mL NH4Cl溶液,需再向A中加入9mL蒸馏水,使两份溶液总体积相等,确保其他条件相同,而NH4Cl的浓度不同。故答案为:9,使两份溶液总体积相等,确保其他条件相同,而NH4Cl的浓度不同;
(5)偏钒酸铵和草酸(H2C2O4)发生氧化还原反应,生成络合物(NH4)2[(VO)2(C2O4)3],矾的化合价从+5价降低到+4价,那么碳的化合价就会从+3价升高到+4价,根据电子守恒,得到该反应的化学方程式为2NH4VO3+4H2C2O4=(NH4)2[(VO)2(C2O4)3]+2CO2↑+4H2O。


科目:高中化学 来源: 题型:
【题目】普洱茶具有独特的香气,是云南的旅游名片之一。橙花叔醇是影响其香气的物质之一,结构如图所示。下列说法正确的是
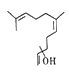
A. 该物质的化学式是C15H26O
B. 该物质不能使酸性高锰酸钾溶液褪色
C. 该物质的同分异构体可以是芳香族化合物
D. 该物质可以发生加成反应,不能发生消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸铜[(CH3COO)2Cu·H2O](其相对式量为200)常用作分析化学的分析试剂,还用作有机合成催化剂、瓷釉颜料等。可以用碱式碳酸铜与醋酸作用来制备。
实验步骤:
(I)碱式碳酸铜的制备

(Ⅱ)醋酸铜的制备
碱式碳酸铜与醋酸反应制得醋酸铜:
Cu(OH)2·CuCO3+4CH3COOH=2(CH3COO)2Cu·H2O+CO2↑+H2O
将产品碱式碳酸铜放入烧杯内,加入约20mL蒸馏水,加热搅拌至323K左右,逐滴加入适量醋酸至固体不再溶解,趁热过滤。滤液在通风橱下蒸发至原体积的![]() 左右,冷却至室温,减压过滤,用少量蒸馏水洗涤,得(CH3COO)2Cu·H2O产品,称量,计算产率。
左右,冷却至室温,减压过滤,用少量蒸馏水洗涤,得(CH3COO)2Cu·H2O产品,称量,计算产率。
回答下列问题:
(1)步骤(ⅰ)将研磨后混合物注入热水中反应,写出离子反应方程式______。
(2)碱式碳酸铜的制备需在热水中进行反应,且温度需控制在60℃左右,请解释原因______。
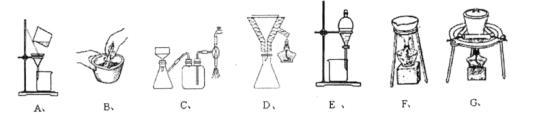
(3)在步骤(ⅰ)与步骤(ⅱ)的实验过程中,涉及三种固液分离的方法,分别是倾析法过滤、趁热过滤与减压过滤,下列装置中没有使用到的有______。
(4)步骤ⅱ中洗涤晶体的具体操作是______。
(5)最终称量所得的产品为8.0g,则产率为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】单斜硫和正交硫转化为二氧化硫的能量变化图如下图,下列说法正确的是:
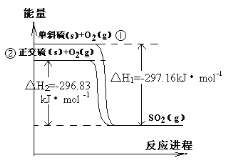
A. 单斜硫没有正交硫稳定
B. S(s,单斜)=S(s,正交) △H=+0.33 kJ· mol-1
C. 相同物质的量的正交硫比单斜硫所含有的能量高
D. ①式表示断裂l mol O2中的共价键所吸收的能量比形成1 mol SO2中的共价键所放出的能量少297.16 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯在不同的条件下可被氧化成不同产物,如A、B、C。已知:取0.01mol A与足量的钠完全反应后,生成224mL(标准状况)气体。C是B的同分异构体,C与新制的氢氧化铜浊液一起加热,会产生红色沉淀。
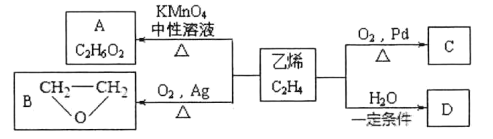
已知:一个碳原子上连有二个-OH基团是不稳定的结构。
(1)C中含有的官能团名称是______,乙烯转化为D的反应类型______;
(2)写出D与氧气反应生成C的化学方程式______;
(3)下列说法正确的是______。
A. B分子中的所有原子在同一平面上
B. 一定条件下,B能与CO2聚合生成可降解的高分子
C. 乙烯在一定条件下被氧气氧化也能生成乙酸
D. A与D是同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为原子序数依次增大的短周期主族元素,A元素的一种单质是自然界最硬的物质,B为最活泼的非金属元素,C元素的原子的电子层数是最外层电子数的3倍,D元素最高化合价为+6价。
(1)D在周期表中的位置是 _____________,E的离子结构示意图_____________;
(2)C与D 形成化合物的电子式为_____________;
(3)A、D、E三种元素的最高价氧化物对应水化物的酸性由强到弱的顺序是______;
(4)由B、C、D形成的简单离子半径由大到小的顺序是________________;
(5)B形成的氢化物沸点比E形成的氢化物沸点_______(填“高”或“低”),原因是___________;
(6)DBn做制冷剂替代氟利昂,对臭氧层完全没有破坏作用,是一种很有发展潜力的制冷剂.该物质的摩尔质量为146g/mol,该物质的化学式为____。已知DBn在温度高于45°时为气态,DBn属于____晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组研究在其他条件不变时,改变密闭容器中某一条件对A2(g)+3B2(g) ![]() 2AB3(g)化学平衡状态的影响,得到如图所示的曲线(图中T表示温度,n表示物质的量)。下列判断不正确的是( )
2AB3(g)化学平衡状态的影响,得到如图所示的曲线(图中T表示温度,n表示物质的量)。下列判断不正确的是( )
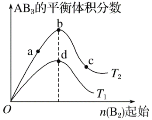
A. 若T2<T1,则正反应一定是放热反应
B. 在T2和n(A2)不变时达到平衡,AB3的物质的量大小为c>b>a
C. 达到平衡时A2的转化率大小为b>a>c
D. 若T2<T1,达到平衡时b、d点的反应速率为vd>vb
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验室可以用KMnO4制备氯气,反应方程式如下:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
①该反应的氧化剂是____,氧化产物是_____,还原产物是____。
②当有15.8gKMnO4参加反应时,被氧化的HCl有___mol,标况下生成Cl2的体积为____L,有____mol电子转移。
(2)A的核电荷数为n,A2+和B3-的电子层结构相同,则B原子的质子数是__。
(3)在1H216O、2H217O、2H218O、1H35Cl、1H37Cl中,共存在__种原子,_种元素。
(4)将K(Al2Si3O9)(OH)改写为氧化物形式:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A和B两种有机物可以互溶,有关性质如下:
物质 | 密度(g·cm-3) | 熔点/℃ | 沸点/℃ | 溶解性 |
A | 0.7893 | -117.3 | 78.5 | 与水以任意比混溶 |
B | 0.7137 | -116.6 | 34.5 | 不溶于水 |
(1)要除去A和B的混合物中的少量B,可采用的_______________方法可得到A。
A.蒸馏 B.重结晶 C.萃取 D.加水充分振荡,分液
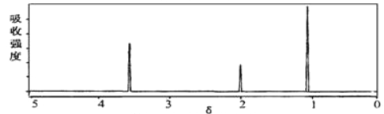
(2)将有机物A置于氧气流中充分燃烧,A和氧气恰好完全反应且消耗6.72L(标准状况)氧气,生成5.4gH2O和8.8gCO2,则该物质的实验式是__________;质谱图显示,A的相对分子质量为46,又已知有机物A的核磁共振氢谱如图所示,则A的结构简式为________________。
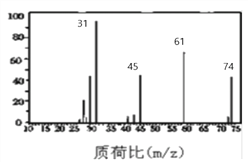
(3)下图是B的质谱图,则其相对分子质量为 ________ ,
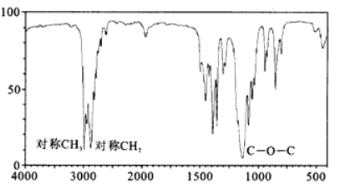
(4)B的红外光谱如图所示,则B的结构简式为__________________________。
(5)准确称取一定质量的A和B的混合物,在足量氧气充分燃烧,将产物依次通过足量的无水氯化钙和碱石灰,发现质量分别增加14.4g和26.4g。计算混合物中A和B的物质的量之比_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com