
【题目】普洱茶具有独特的香气,是云南的旅游名片之一。橙花叔醇是影响其香气的物质之一,结构如图所示。下列说法正确的是
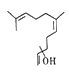
A. 该物质的化学式是C15H26O
B. 该物质不能使酸性高锰酸钾溶液褪色
C. 该物质的同分异构体可以是芳香族化合物
D. 该物质可以发生加成反应,不能发生消去反应
科目:高中化学 来源: 题型:
【题目】明矾[KAl(SO4)2·12H2O]在生产、生活中有广泛用途:饮用水的净化;造纸工业上作施胶剂;食品工业的发酵剂等。利用炼铝厂的废料——铝灰(含Al、Al2O3及少量SiO2和FeO·xFe2O3)可制备明矾。工艺流程如下:回答下列问题:
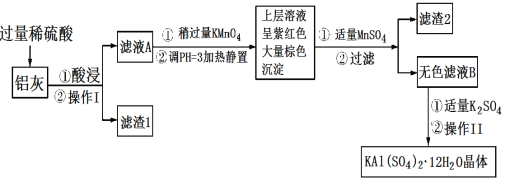
(1)明矾净水的原理是______________(用离子方程式表示)。
(2)操作Ⅰ是________,操作Ⅱ是蒸发浓缩、__________、过滤、洗涤、干燥。
(3)检验滤液A中是否存在Fe2+的试剂是__________(只用一种试剂)。
(4)将铝灰投入氢氧化钠溶液中生成气体的化学方程式是__________,在滤液A中加入高锰酸钾发生反应的离子方程式为(该条件下MnO4-转化为Mn2+):_______。
(5)已知:在pH=3、加热条件下,MnO4-可与Mn2+反应生成MnO2。加入MnSO4发生反应的离子方程式为:________,滤渣2含有的物质是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将pH=1的硫酸溶液平均分成两等份,一份加入适量水,另一份加入与该硫酸溶液物质的量浓度相同的NaOH溶液,两者pH都升高了1。则加入水和加入NaOH溶液的体积比约为( )
A. 11∶1 B. 10∶1 C. 6∶1 D. 5∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用98%的浓硫酸(密度为1.84g/cm3)配制100mL 1.0mol/L的稀硫酸,现给出下列仪器(配制过程中可能用到):
A.100mL量筒 B.托盘天平 C.玻璃棒 D.50mL容量瓶
E.10mL量筒F.胶头滴管 G.50mL烧杯 H.100mL容量瓶
(1)需量取浓硫酸的体积为________mL
(2)实验时选用的仪器有________
(3)配制过程中,下列情况会使配制结果偏高的是________ (填序号)
①定容时俯视刻度线观察液面
②容量瓶使用时未干燥
③定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
④量取浓硫酸时仰视量简刻度
⑤移液时未洗涤烧杯和玻璃棒
(4)在容量规使用方法中,下列操做不正确的是________ (填序号)
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配液润洗
C.将氢氧化钠固体放在天平托盘的滤纸上,准确称量并放入烧杯中溶解后,立即注入容量瓶
D.将准确量取的18.4mol/L的硫酸,注入已盛有30mL水的100mL的容量瓶中,加水至刻度线
E.定容后塞好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化铝(AlON)具有多晶陶瓷在材料制备方面的优势,有着广阔的应用前景。工业上利用某铝土矿(含Al2O3及少量的MgO等杂质)生产氮氧化铝的流程如图所示。回答下列问题:
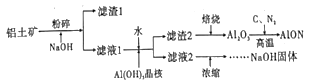
(1)为提高铝土矿碱浸的速率,除粉碎外,还可以采取的措施是_____(写出一项即可)
(2)滤液1的溶质有NaOH、_____。滤渣2的成分是_____。向滤液1中加水的目的是_______。该过程也可用通入足量的_____气体的方法来代替。
(3)滤液2浓缩的过程中常会吸收空气中的CO2,为得到纯净的NaOH,需要加入适量____(填化学式)。整个流程中,可循环的物质是_____。
(4)写出制备AlON的化学方程式_______。
(5)取1吨Al2O3质量分数为91.8%的铝土矿样品,利用上述流程AlON,最终制得氮氧化铝820.8kg,则氮氧化铝的产率为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数的值,下列有关说法正确的是
A. 60g冰醋酸晶体中,含阴离子数目为NA
B. 标准状况下,22.4LCCl4中含有分子的数目为NA
C. 常温下,46gNO2与N2O4混合气体中含分子数为NA
D. 32gCu投入300mL10mol/L的浓硝酸中,充分反应后转移电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H(![]() ),是一种常见的抗结肠炎药物。如图是利用芳香烃A为原料设计制备H的路线。
),是一种常见的抗结肠炎药物。如图是利用芳香烃A为原料设计制备H的路线。
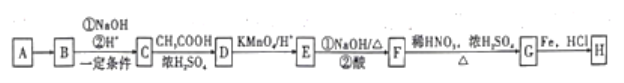
已知:①A蒸气的密度是相同条件下氢气密度的46倍;
②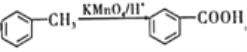 。
。
回答下列问题
(1)A的名称是_______,C中含有官能团的名称是____。
(2)写出C生成D的化学方程式:______,该反应的类型是______。
(3)G的结构简式是______。
(4)设计C→D和E→F两步反应的目的是______。
(5)化合物X是D的同分异构体,符合下列条件的X共______种。
①芳香族化合物,且苯环上有两个取代基②能发生水解反应
写出其中核磁共振氢谱显示有4种不同化学环境的氢原子,峰面积之比为3:3:2:2的所有X的结构简式:______。
(6)已知![]() 易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻、对位,而当苯环上连有羧基时则取代在间位。据此写出以A为原料制备化合物
易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻、对位,而当苯环上连有羧基时则取代在间位。据此写出以A为原料制备化合物![]() 的合成路线(无机试剂任选)___________。
的合成路线(无机试剂任选)___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分子或离子中中心原子价层电子对几何构型为四面体且分子或离子空间的构型为V形的是( )
A. NH4+ B. PH3 C. H3O+ D. OF2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】偏钒酸铵(NH4VO3)主要用作催化剂、催干剂、媒染剂等。用沉淀法除去工业级偏钒酸铵中的杂质硅、磷的流程如图:
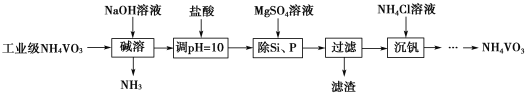
(1)碱溶时,下列措施有利于NH3逸出的是____(填字母序号)。
a.升高温度 b.增大压强 c.增大NaOH溶液的浓度
(2)①滤渣的主要成分为Mg3(PO4)2、MgSiO3,已知Ksp(MgSiO3)=2.4×10-5,若滤液中c(SiO32-)=0.08mol·L-1,则c(Mg2+)=____。
②由图可知,加入一定量的MgSO4溶液作沉淀剂时,随着温度的升高,除磷率下降,其原因是温度升高,Mg3(PO4)2溶解度增大和促进Mg2+水解生成Mg(OH)2;但随着温度的升高,除硅率升高,其原因是____(用离子方程式表示)。
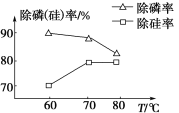
(3)沉钒时,反应温度需控制在50℃,在实验室可采取的加热方式为____。
(4)探究NH4Cl的浓度对沉钒率的影响,设计实验步骤(常见试剂任选):取两份10mL一定浓度的滤液A和B,分别加入1mL和10mL的1mol·L-1 NH4Cl溶液,再向A中加入___mL蒸馏水,控制两份溶液的温度均为50℃、pH均为8,由专用仪器测定沉钒率,加入蒸馏水的目的是____。
(5)偏钒酸铵本身在水中的溶解度不大,但在草酸(H2C2O4)溶液中因发生氧化还原反应而溶解,同时生成络合物(NH4)2[(VO)2(C2O4)3],该反应的化学方程式为____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com