
【题目】A和B两种有机物可以互溶,有关性质如下:
物质 | 密度(g·cm-3) | 熔点/℃ | 沸点/℃ | 溶解性 |
A | 0.7893 | -117.3 | 78.5 | 与水以任意比混溶 |
B | 0.7137 | -116.6 | 34.5 | 不溶于水 |
(1)要除去A和B的混合物中的少量B,可采用的_______________方法可得到A。
A.蒸馏 B.重结晶 C.萃取 D.加水充分振荡,分液
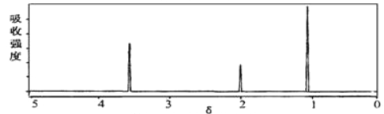
(2)将有机物A置于氧气流中充分燃烧,A和氧气恰好完全反应且消耗6.72L(标准状况)氧气,生成5.4gH2O和8.8gCO2,则该物质的实验式是__________;质谱图显示,A的相对分子质量为46,又已知有机物A的核磁共振氢谱如图所示,则A的结构简式为________________。
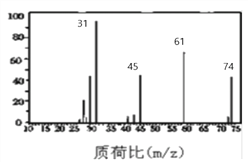
(3)下图是B的质谱图,则其相对分子质量为 ________ ,
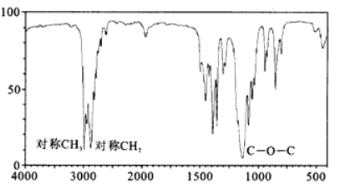
(4)B的红外光谱如图所示,则B的结构简式为__________________________。
(5)准确称取一定质量的A和B的混合物,在足量氧气充分燃烧,将产物依次通过足量的无水氯化钙和碱石灰,发现质量分别增加14.4g和26.4g。计算混合物中A和B的物质的量之比_____________________。
【答案】A C2H6O CH3CH2OH 74 CH3CH2-O-CH2CH3 1:1
【解析】
根据提示信息了解未知化合物的物理性质从而推断混合物的分离和提纯方法;根据各种谱图推断有机化合物的结构和性质;根据质量守恒原理计算分析解答。
(1)由表格中的信息可知,A. B两种有机物互溶,但沸点不同,则选择蒸馏法分离,故A正确;
故答案为:A;
(2)根据质量守恒定律可知,化合物中所含C元素质量为:8.8g×![]() =2.4g,所含H元素质量为:5.4g×
=2.4g,所含H元素质量为:5.4g×![]() =0.6g,二氧化碳和水中的氧元素质量之和为(8.8g2.4g)+(5.4g0.6g)=11.2g,而氧气的质量为
=0.6g,二氧化碳和水中的氧元素质量之和为(8.8g2.4g)+(5.4g0.6g)=11.2g,而氧气的质量为![]() ×32g/mol=9.6g,所以有机物中氧元素质量为11.2g9.6g=1.6g,n(C):n(H):n(O)=
×32g/mol=9.6g,所以有机物中氧元素质量为11.2g9.6g=1.6g,n(C):n(H):n(O)= ![]() :
:![]() :
:![]() =2:6:1,所以化合物的最简式是C2H6O,在最简式C2H6O中,C、H原子已经达到饱和,其实验式即为分子式,即分子式为C2H6O,该化合物可能为乙醇,也可能为二甲醚,而核磁共振氢谱表明其分子中有三种化学环境不同的氢原子,强度之比为3:2:1,则该化合物为乙醇,结构简式为CH3CH2OH;
=2:6:1,所以化合物的最简式是C2H6O,在最简式C2H6O中,C、H原子已经达到饱和,其实验式即为分子式,即分子式为C2H6O,该化合物可能为乙醇,也可能为二甲醚,而核磁共振氢谱表明其分子中有三种化学环境不同的氢原子,强度之比为3:2:1,则该化合物为乙醇,结构简式为CH3CH2OH;
故答案为:C2H6O,CH3CH2OH;
(3)由物质B的质谱图可知,B的相对分子质量为74,
故答案为:74;
(4)由物质B的红外光谱可知,物质B存在对称的甲基、对称的亚甲基和醚键可得分子的结构简式为:CH3CH2OCH2CH3,
故答案为:CH3CH2OCH2CH3;
(5)将燃烧产物依次通过足量的无水氯化钙和碱石灰,增加的14.4g即水的质量,增加的26.4g即二氧化碳的质量,可得到:n(H2O)= ![]() =0.8mol,n(CO2)=
=0.8mol,n(CO2)= ![]() =0.6mol,设CH3CH2OH、CH3CH2OCH2CH3的物质的量为x、y,则根据C原子和H原子守恒可得2x+4y=0.6;6x+10y=0.8×2;解得:x=0.1mol,y=0.1mol,则A和B的物质的量之比1:1;
=0.6mol,设CH3CH2OH、CH3CH2OCH2CH3的物质的量为x、y,则根据C原子和H原子守恒可得2x+4y=0.6;6x+10y=0.8×2;解得:x=0.1mol,y=0.1mol,则A和B的物质的量之比1:1;
故答案为:1:1。


科目:高中化学 来源: 题型:
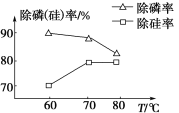
【题目】偏钒酸铵(NH4VO3)主要用作催化剂、催干剂、媒染剂等。用沉淀法除去工业级偏钒酸铵中的杂质硅、磷的流程如图:
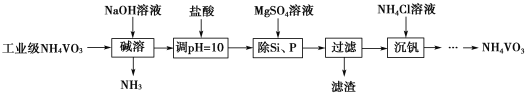
(1)碱溶时,下列措施有利于NH3逸出的是____(填字母序号)。
a.升高温度 b.增大压强 c.增大NaOH溶液的浓度
(2)①滤渣的主要成分为Mg3(PO4)2、MgSiO3,已知Ksp(MgSiO3)=2.4×10-5,若滤液中c(SiO32-)=0.08mol·L-1,则c(Mg2+)=____。
②由图可知,加入一定量的MgSO4溶液作沉淀剂时,随着温度的升高,除磷率下降,其原因是温度升高,Mg3(PO4)2溶解度增大和促进Mg2+水解生成Mg(OH)2;但随着温度的升高,除硅率升高,其原因是____(用离子方程式表示)。
(3)沉钒时,反应温度需控制在50℃,在实验室可采取的加热方式为____。
(4)探究NH4Cl的浓度对沉钒率的影响,设计实验步骤(常见试剂任选):取两份10mL一定浓度的滤液A和B,分别加入1mL和10mL的1mol·L-1 NH4Cl溶液,再向A中加入___mL蒸馏水,控制两份溶液的温度均为50℃、pH均为8,由专用仪器测定沉钒率,加入蒸馏水的目的是____。
(5)偏钒酸铵本身在水中的溶解度不大,但在草酸(H2C2O4)溶液中因发生氧化还原反应而溶解,同时生成络合物(NH4)2[(VO)2(C2O4)3],该反应的化学方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
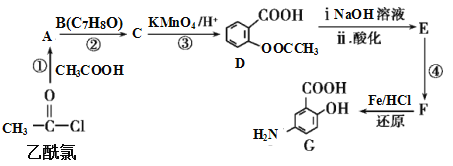
【题目】有机合成是制药工业中的重要手段。G是某抗炎症药物的中间体,其合成路线如图:
已知:
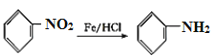
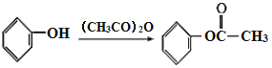 ,
,
(1)B的结构简式为_____。
(2)反应④的条件为____;①的反应类型为___;反应②的作用是____。
(3)下列对有机物G的性质推测正确的是____(填选项字母)。
A.具有两性,既能与酸反应也能与碱反应
B.能发生消去反应、取代反应和氧化反应
C.能聚合成高分子化合物
D.1mol G与足量NaHCO3溶液反应放出2mol CO2
(4)D与足量的NaOH溶液反应的化学方程式为_____。
(5)符合下列条件的C的同分异构体有___种。
A.属于芳香族化合物,且含有两个甲基 B.能发生银镜反应 C.与FeCl3溶液发生显色反应
其中核磁共振氢谱有4组峰,且峰面积之比为6∶2∶1∶1的是___(写出其中一种的结构简式)。
(6)已知:苯环上有烷烃基时,新引入的取代基连在苯环的邻、对位;苯环上有羧基时,新引入的取代基连在苯环的间位。根据题中的信息,写出以甲苯为原料合成有机物![]() 的流程图(无机试剂任选)。_______
的流程图(无机试剂任选)。_______
合成路线流程图示例如图:X![]() Y
Y![]() Z…目标产物
Z…目标产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随原子序数的递增,八种短周期元素(用字母表示)原子半径的相对大小、最高正价或最低负价的变化如图所示。根据判断出的元素回答问题:
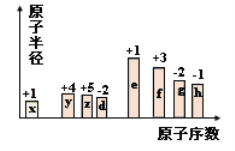
(1)f在元素周期表的位置是_______。
(2)上述元素形成的简单阴、阳离子中,离子半径最大的是(用化学式表示,下同)_______________;在e、f、g、h四种元素的最高价氧化物对应的水化物中的酸性最强的是___________________。
(3)d、e能形成原子个数比为1:1的化合物,该化合物的电子式为________________,0.1 mol该化合物与足量水反应时转移的电子数为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究性学习小组的同学,为测定某含镁3%~5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列两种不同实验方案进行探究。填写下列空白。
(实验方案)将铝镁合金与足量稀硫酸溶液反应,测定生成气体在通常状况(约20℃,1.01![]() 105Pa)的体积。
105Pa)的体积。
(问题讨论)
(1)同学们拟选用下列实验装置完成实验:
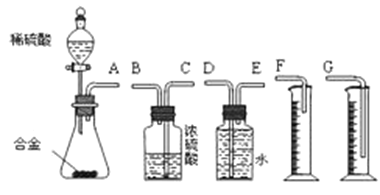
①最简易的装置需要上述三个仪器,它们的其连接顺序是:A接( )( )接( )____________
②实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,一会儿后稀硫酸也不能顺利滴入锥形瓶。猜测可能的原因是__________________________________________。
③实验结束时,在读取测量实验中生成氢气的体积时,你认为合理的是___________ 。
A.待实验装置冷却后再读数
B.上下移动量筒F,使其中液面与广口瓶中液面相平
C.上下移动量筒G,使其中液面与广口瓶中液面相平
D.视线与凹液面的最低点水平,读取量筒中水的体积
(2)仔细分析实验装置后,同学们经讨论认为以下两点会引起较大误差:稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小。于是他们设计了如图所示的实验装置。
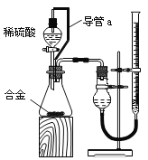
①装置中导管a的作用是_______________________________;打开分液漏斗活塞时稀硫酸能顺利滴下,滴入锥形瓶的稀硫酸体积等于进入分液漏斗的气体体积,从而消除由于加入稀硫酸引起的氢气体积误差。
②实验前后碱式滴定管中液面读数分别为V1 mL、V2 mL。则产生氢气的体积为________ mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】每年的6月26日是国际禁毒日,珍爱生命,远离毒品。以下是四种毒品的结构简式,下列有关说法正确的是

A. 四种毒品中都含有苯环,都属于芳香烃
B. 摇头丸经消去、加成反应可制取冰毒
C. 1 mol大麻与溴水反应最多消耗4 mol Br2
D. 氯胺酮分子中环上所有碳原子可能共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、含苯酚的工业废水的处理流程如图所示。
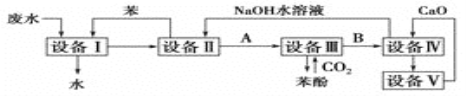
(1)①流程图设备Ⅰ中进行的是____操作(填写操作名称)。实验室里这一步操作可以用_______(填仪器名称)进行。
②向设备Ⅱ加入NaOH溶液目的是________(填化学方程式),由设备Ⅱ进入设备Ⅲ的物质A是________(填化学式),由设备Ⅲ进入设备Ⅳ的物质B是________。
③在设备Ⅲ中发生反应的化学方程式为___________________________________。
④在设备Ⅳ中,CaO与水反应后的产物与B的水溶液反应的化学方程式为_____________。通过________(填操作名称)操作,可以使产物相互分离。
⑤图中,能循环使用的物质是________、________、________、和________。
(2)为了防止水源污染,用简单而又现象明显的方法检验某工厂排放的污水中有无苯酚,此方法是_______。
(3)从溶有乙醇的苯酚溶液中回收苯酚有下列操作①蒸馏②过滤③静置分液④加入足量的金属钠⑤通入过量的CO2气体⑥加入足量的NaOH溶液⑦加入足量的FeCl3溶液 ⑧加入硫酸与NaBr共热,合理的步骤是___________
Ⅱ.某化学兴趣小组的同学在乙醛溶液中加入溴水,溴水褪色。分析乙醛的结构和性质,同学们认为溴水褪色的原因有三种可能(请补充完整):
①溴在不饱和键上发生加成反应。
②溴与甲基上的氢原子发生取代反应。
③______________________。
为确定此反应的机理,同学们进行了如下探究:
(1)向反应后的溶液中加入硝酸银溶液,若有沉淀产生,则上述第________种可能被排除。
(2)有同学提出通过检测反应后溶液的酸碱性作进一步验证,就可确定该反应究竟是何种反应原理。此方案是否可行?________,理由是__________________________。
(3)若反应物Br2与生成物Br-的物质的量之比是1∶2,则乙醛与溴水反应的化学方程式为________________________。
(4)已知烯烃能发生如下反应: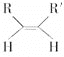
![]() RCHO+R′CHO请写出下列反应产物的结构简式:
RCHO+R′CHO请写出下列反应产物的结构简式:
![]() ___________________________________________;
___________________________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼氢化物NaBH4(B元素的化合价为+3价)燃料电池(DBFC), 由于具有效率高、产物清洁无污染和燃料易于储存和运输等优点,被认为是一种很有发展潜力的燃料电池。其工作原理如下图所示,下列说法正确的是
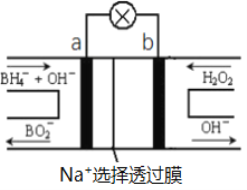
A. 电池的负极反应为BH4-+2H2O-8e-=BO2-+8H+
B. 放电时,每转移1mol电子,理论上有1molNa+透过选择透过膜
C. 电池放电时Na+从b极区移向a极区
D. 电极a发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出如图中序号①~④仪器的名称:
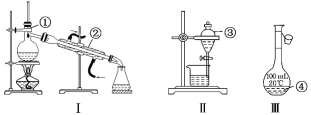
(1)①_____;②____;③_____;④_____。
(2)仪器①~④中,使用时必须检查是否漏水的有____(填仪器序号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com