
【题目】有机物Z是制备药物的中间体,合成Z的路线如下图所示,下列有关叙述不正确的是
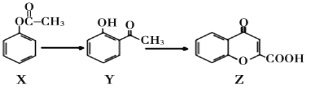
A. X的分子式为C8H8O2
B. X、Y、Z均能和NaOH溶液反应
C. 可用NaHCO3溶液鉴别Y和Z
D. 1mol X跟足量H2反应,最多消耗4mol H2
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
【题目】某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图Ⅰ~Ⅳ所示。
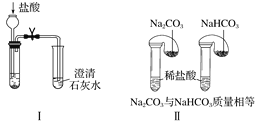
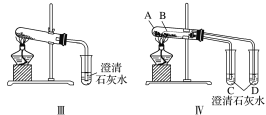
(1)图Ⅰ、Ⅱ所示实验中,__(填序号)能够较好达到实验目的。
(2)图Ⅲ、Ⅳ所示实验均能鉴别这两种物质,两个实验的发生装置中反应的化学方程式为:__;与实验Ⅲ相比,实验Ⅳ的优点是___(填字母)。
A.Ⅳ比Ⅲ复杂
B.Ⅳ比Ⅲ安全
C.Ⅳ比Ⅲ操作简便
D.Ⅳ可以做到用一套装置同时进行两个对比实验,而Ⅲ不行
(3)若用实验Ⅳ验证碳酸钠和碳酸氢钠的稳定性,则试管B中装入的固体最好是__(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是从元素周期表中截取的一部分,已知X、Y、Z、W为四种短周期主族元素,下列说法中不正确的是
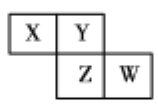
A. W的原子序数可能是X的原子序数的3倍
B. Z元素不可能为金属元素
C. 四种元素的原子有可能均能与氢原子形成18电子分子
D. W的气态氢化物的稳定性一定比Y的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘是人体中不可缺少的元素,为了预防碘缺乏,通常在精盐中添加一定的KIO3。某研究小组为了检测某加碘盐中是否含有碘,查阅了有关资料,发现其检测原理是:KIO3 + 5KI + 3H2SO4 = 3I2 + 3K2SO4 + 3H2O
(1)用双线桥表示该反应中电子转移的方向和数目___________________________________,该反应中还原产物与氧化产物的质量之比是__________,0.2mol KIO3参加反应时,转移的电子为________mol。
(2)上面实验中用到一定物质的量浓度的稀硫酸,若配制1.0 mol/L的稀硫酸500mL,配制中需要用到的主要玻璃仪器有___________(填选项),需用18.0mol/L 浓硫酸_________mL。
a.100mL量筒 b.玻璃棒 c.100mL容量瓶 d.50mL量筒 e.胶头滴管
f.烧杯 g.500mL容量瓶
(3)下面操作造成所配稀硫酸溶液浓度偏高的有____________(填选项)。
a.溶解后溶液没有冷却到室温就转移;b.转移时没有洗涤烧杯、玻璃棒;c.转移过程中有少量液体流出;d.向容量瓶加水定容时眼睛俯视液面;e.摇匀后发现液面低于刻度线,又加蒸馏水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G、W是原子序数依次增大的8种元素,A元素原子的2p原子轨道上有 2个未成对的电子,B元素在同周期中原子半径最大,与A可形成原子个数比为1 : 1和2 : 1的两种化合物,C单质是一种常见的半导体材料,F有 9个原子轨道,G的单质是一种常见金属,W能形成红色(或砖红色)的W2A和黑色的WA两种氧化物。
(1)A元素在元素周期表中的位置是__________;写出B元素与A形成原子个数比为1 : 1的化合物的电子式____________________________ ;
(2)写出C基态时的价电子排布式:_______________________;
(3)D、E、F三者第一电离能从大到小的顺序是__________(用元素符号及“ > ”表示)。
(4)G位于元素周期表的位置是_________________, G3+比G2+稳定,原因是____________;
(5)W能形成红色(或砖红色)的W2A, W2A的化学式为_______________ ,W在周期表的_____ 区。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 钠和冷水反应:Na+2H2O=Na++2OH+H2↑
B. 澄清石灰水与少量NaHCO3溶液混合:Ca2+ + OH-+ HCO3-![]() CaCO3↓+ H2O
CaCO3↓+ H2O
C. 向沸水中滴入适量的饱和氯化铁溶液;Fe 3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
D. 碳酸氢铵溶液中加入过量氢氧化钠溶液 HCO3-+ OH-=CO32-+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾天气严重影响人们的生活,其中氮氧化物和硫氧化物是造成雾霾天气的主要原因之一,以下方法可以消除氮氧化物和硫氧化物的污染。
(1)用活性炭还原法可处理氮氧化物,向某密闭容器中加入一定量的活性炭和NO,发生反应:![]() △H<0,在一定条件下,反应进行到不同时间测得各物质的浓度如下表。
△H<0,在一定条件下,反应进行到不同时间测得各物质的浓度如下表。
时间/min 浓度/mol·L-1 | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.52 | 0.40 | 0.40 | 0.44 | 0.44 |
N2 | 0 | 0.24 | 0.30 | 0.30 | 0.28 | 0.28 |
CO2 | 0 | 0.24 | 0.30 | 0.30 | 0.28 | 0.28 |
①0~10min内,NO的平均反应速率v(NO)=_______________。
②在恒容条件下,能判断该反应一定达到化学平衡状态的标志是_________(填字母编号)。
a.v正(N2)=2v逆(NO) b.反应体系的压强不再发生改变
c.![]() 不变 d.混合气体的密度保持不变
不变 d.混合气体的密度保持不变
③30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是___________。
(2)NH3催化还原氮氧化物技术是目前应用最广泛的烟气氮氧化物脱除技术。已知c(NO2):c(NO)=1:1时脱氮效果最佳,若生成1mol N2时反应放出的热量为Q kJ。此时对应的脱氮反应的热化学方程式为_____________________________________________________。
(3)利用钠碱循环法可脱除烟气中的SO2。
①在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是_____________________。
②吸收液吸收SO2的过程中,pH随n(![]() ):n(
):n(![]() )变化关系如下表:
)变化关系如下表:
n( | 91:9 | 1:1 | 9:91 |
pH | 8.2 | 7.2 | 6.2 |
当吸收液的pH降至约为6时,需送至电解槽再生。再生示意图如下:
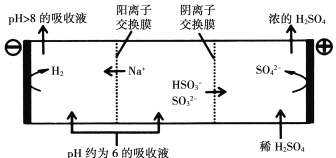
写出![]() 在阳极放电的电极反应式:_______________________________________,当阴极室中溶液pH升至8以上时,吸收液再生并循环利用。
在阳极放电的电极反应式:_______________________________________,当阴极室中溶液pH升至8以上时,吸收液再生并循环利用。
(4)利用喷雾干燥法脱硫工艺是除去SO2的常见方法,先将含SO2的废气溶于水,再用饱和石灰浆吸收。该温度下吸收液中c(Ca2+)一直保持为0.50 mol·L-1,已知KSP(CaSO3)=1.4×10-7,求吸收后溶液中![]() 的浓度______________________。
的浓度______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年10月15日,中国用“长征三号乙”运载火箭成功以“一箭双星”方式发射北斗三号全球组网卫星系统第15、16号卫星,其火箭推进剂为高氯酸铵(NH4ClO4)等。制备NH4ClO4的工艺流程如下:
饱和食盐水![]() NaClO3
NaClO3![]() NaClO4
NaClO4![]() NaClO4
NaClO4![]() NH4ClO4
NH4ClO4
下列说法错误的是( )
A. NH4ClO4属于离子化合物
B. 溶解度:NaClO4>NH4ClO4
C. 该流程中可循环利用的物质是NH4Cl
D. 高氯酸铵中氯元素的化合价为+7价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NH4HCO3![]() NH3↑+CO2↑+H2O↑。为了将混有硫酸钠、碳酸氢铵的NaCl提纯,并制得纯净的NaCl溶液,某学生设计如下实验方案:
NH3↑+CO2↑+H2O↑。为了将混有硫酸钠、碳酸氢铵的NaCl提纯,并制得纯净的NaCl溶液,某学生设计如下实验方案:
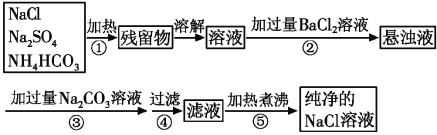
(1)操作④中所需的玻璃仪器有_________________________________。
(2)操作②为什么不用硝酸钡溶液,其理由是________________________________。
(3)进行操作②后,如何判断SO![]() 已除尽,方法是___________________________。
已除尽,方法是___________________________。
(4)操作③的目的是__________,其相应的离子方程式为:____________________。
(5)说明此设计方案不严密之处____________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com