
【题目】碘是人体中不可缺少的元素,为了预防碘缺乏,通常在精盐中添加一定的KIO3。某研究小组为了检测某加碘盐中是否含有碘,查阅了有关资料,发现其检测原理是:KIO3 + 5KI + 3H2SO4 = 3I2 + 3K2SO4 + 3H2O
(1)用双线桥表示该反应中电子转移的方向和数目___________________________________,该反应中还原产物与氧化产物的质量之比是__________,0.2mol KIO3参加反应时,转移的电子为________mol。
(2)上面实验中用到一定物质的量浓度的稀硫酸,若配制1.0 mol/L的稀硫酸500mL,配制中需要用到的主要玻璃仪器有___________(填选项),需用18.0mol/L 浓硫酸_________mL。
a.100mL量筒 b.玻璃棒 c.100mL容量瓶 d.50mL量筒 e.胶头滴管
f.烧杯 g.500mL容量瓶
(3)下面操作造成所配稀硫酸溶液浓度偏高的有____________(填选项)。
a.溶解后溶液没有冷却到室温就转移;b.转移时没有洗涤烧杯、玻璃棒;c.转移过程中有少量液体流出;d.向容量瓶加水定容时眼睛俯视液面;e.摇匀后发现液面低于刻度线,又加蒸馏水至刻度线
【答案】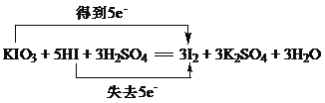 1:5 1 bdefg 27.8 ad
1:5 1 bdefg 27.8 ad
【解析】
(1)根据氧化还原反应中化合价的升降情况来标电子转移情况;碘酸钾中碘元素化合价降低是氧化剂,碘化钾中碘元素的化合价升高是还原剂;根据化合价的变化情况分析出电子的转移的物质的量;
(2)利用稀释定律C浓V浓=C稀V稀来计算;根据配制一定物质的量浓度的溶液的步骤是:计算、量取、稀释、移液、洗涤、定容、摇匀来选择使用的仪器;
(3)根据C=n÷V,通过判断不当操作对溶质的物质的量n和溶液体积V的影响来分析误差。
(1)氧化还原反应KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O中,I元素的化合价由+5价降低为0,I元素的化合价由-1价升高为0,化合价升高值=化合价降低值=转移电子数=5,电子转移情况如下: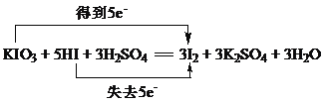 ;
;
KI为还原剂,+5价的I元素被还原,还原产物与氧化产物均为碘,由原子守恒及反应可知,物质的量之比为1:5;
根据反应方程式得1mol KIO3参加反应 时转移电子5mol,则0.2mol KIO3参加反应时转移电子0.2×5mol=1mol。
(2)设浓硫酸的体积为VmL,稀释前后溶质物质的量不变,则:1 mol·L-1×0.5L=18mol·L-1×V×10-3L,解得V=27.8mL;配制中需要用到的主要玻璃仪器是b.玻璃棒 d.50mL量筒 e.胶头滴管f.烧杯 g.500mL容量瓶,故选bdefg ;
(3)
a.未冷却到室温就将溶液转移到容量瓶并定容,溶液冷却后体积偏小,配制的溶液浓度偏高,故a正确;
b.转移时没有洗涤烧杯、玻璃棒,导致配制的溶液中溶质的物质的量偏小,配制的溶液浓度偏低,故b错误;
c.转移过程中有少量液体流出,导致配制的溶液中溶质的物质的量偏小,配制的溶液浓度偏低,故c错误;
d.向容量瓶加水定容时眼睛俯视液面,导致加入的蒸馏水体积偏小,配制的溶液体积偏小,溶液浓度偏高,故d正确;
e.摇匀后发现液面低于刻度线,又加蒸馏水至刻度线,配制的溶液体积偏大,溶液浓度偏小,故e错误。
故选 ad。


科目:高中化学 来源: 题型:
【题目】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:
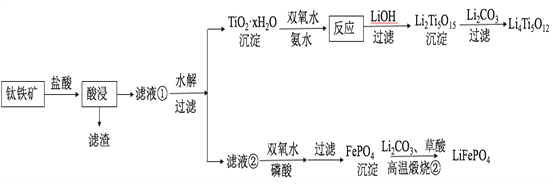
回答下列问题:
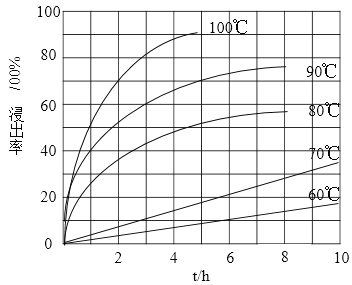
(1)“酸浸”实验中,铁的浸出率结果如下图所示。由图可知,当铁的净出率为70%时,所采用的实验条件为___________________。
(2)“酸浸”后,钛主要以TiOCl42-形式存在,写出相应反应的离子方程式__________________。
(3)TiO2·xH2O沉淀与双氧水、氨水反应40 min所得实验结果如下表所示:
温度/℃ | 30 | 35 | 40 | 45 | 50 |
TiO2·xH2O转化率% | 92 | 95 | 97 | 93 | 88 |
分析40℃时TiO2·xH2O转化率最高的原因__________________。
(4)Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为__________________。
(5)若“滤液②”中c(Mg2+)=0.02 mol/L,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1×10-5 mol/L,此时是否有Mg3(PO4)2沉淀生成?___________(列式计算)。
FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-24。
(6)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. Xe元素的所在族的原子的外围电子排布式均为ns2np6,属于非金属元素
B. 在元素周期表中,s区,d区和ds区的元素都是金属(氢元素除外)
C. 某基态原子核外电子排布图为![]() 它违背了泡利原理
它违背了泡利原理
D. 某外围电子排布为4f75d16s2基态原子,该元素位于周期表中第六周期第ⅢB族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列中心原子的杂化轨道类型和分子几何构型不正确的是
A. PCl3中P原子sp3杂化,为三角锥形
B. BCl3中B原子sp2杂化,为平面三角形
C. CS2中C原子sp杂化,为直线形
D. H2S分子中,S为sp杂化,为直线形
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、对于数以万计的化学物质和化学反应,分类法的作用几乎无可替代。
(1)现有下列五种物质:CaO、CO2、MgO、Fe2O3 、CuO。按照不同的分类标准,它们中有一种物质与其他四种物质有明显的不同,指出这种物质,并写出依据(写出两条依据):
①_________________________________;
②__________________________________。
(2)生活中的食醋和豆浆分别属于分散系中的_______________和_______________。
II、下图为五个椭圆交叉构成的图案,椭圆内分别写了C2H5OH、CO2、Fe2O3、FeCl3和Na2SO4五种物质,图中相连的两种物质均可归为一类,相交的部分A、B、C、D为其相应的分类标准代号。请回答下列问题:
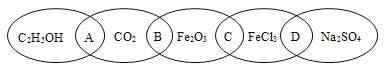
(1)分类标准代号A表示______________(填选项)。
a.两物质都是氧化物 b.两物质的水溶液都可以导电
c.两物质都是含碳化合物 d.两物质都是非电解质
(2)上述五种物质中有一种物质能与稀硫酸在常温下发生化学反应,该反应的离子方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法中正确的有
①0.1mol丙烯酸中含有双键的数目为0.1NA
②12g金刚石中,碳碳共价键数为4NA
③常温下,21g C3H6和C4H8的混合物中含有的碳原子数为1.5NA
④2g ![]() 中含有的质子数、中子数、电子数均为NA
中含有的质子数、中子数、电子数均为NA
⑤常温常压下,S2和S6的混合物共6.4g,其中所含硫原子数一定为0.2NA
⑥10mL 18mol/L的浓硫酸与足量的镁反应时转移的电子数为0.18NA
A. ①⑥B. ④⑤⑥C. ③④⑤D. ①②⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物Z是制备药物的中间体,合成Z的路线如下图所示,下列有关叙述不正确的是
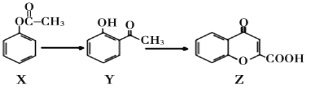
A. X的分子式为C8H8O2
B. X、Y、Z均能和NaOH溶液反应
C. 可用NaHCO3溶液鉴别Y和Z
D. 1mol X跟足量H2反应,最多消耗4mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肯定属于同族元素且性质相似的是( )
A. 原子核外电子排布式:A为1s22s2,B为1s2
B. 结构示意图:A为![]() ,B为
,B为![]()
C. A原子基态时2p轨道上有1个未成对电子,B原子基态时3p轨道上也有1个未成对电子
D. A原子基态时2p轨道上有一对成对电子,B原子基态时3p轨道上也有一对成对电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KIO3是一种重要的无机化合物,可作为食盐中的补碘剂,常见制备方法如下。
(1)氯酸钾氧化法:化学反应方程式为:6I2+11KClO3+3H2O=6KH(IO3)2+5KC1+3C12,每生成3mol KH(IO3)2,反应中转移的电子数为______,向反应后溶液中加______溶液得到KIO3。
(2)一种由含碘废水制取碘酸钾的工艺如图:

①进行“过滤1”时,需同时对CuI沉淀进行洗涤。在洗涤液中可通过滴加______盐溶液来检验其是否已洗涤干净。
②“制FeI2”时,发生反应的化学方程式为______。
③在KIO3、KHSO3的酸性混合溶液中加入少量KI(催化剂)和淀粉,不停地搅拌,反应机理为:第一步IO3-+5I-+6H+=3I2+3H2O第二步反应的离子方程式为______。
当反应进行到1.5min时,溶液突然变为蓝色,随之又很快消失,则第______步反应速率快。
④改变反应温度,重复上述实验,得到温度(T)与溶液变蓝所需时间(t)的关系如图所示(超过50℃后溶液不会再变蓝)。根据图象,请你分析温度低于50℃时,溶液变蓝所需时间与反应温度的关系:_________。

(3)山东省已下调食用盐碘含量标准每千克盐含碘25毫克(波动范围为18~33mgkg-1)。测定食盐试样中碘元素含量的步骤如下:称取4.000g市售食盐加入锥形瓶中,依次加入适量的水、稍过量KI及稀硫酸;充分反应后,再加入12.00mL6.000×10-4molL-1Na2S2O3溶液,与生成的碘恰好完全反应。有关反应原理为:
KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O;I2+2S2O32-=2I-+S4O62-。计算该食盐试样中碘元素的含量______mgkg-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com