
【题目】KIO3是一种重要的无机化合物,可作为食盐中的补碘剂,常见制备方法如下。
(1)氯酸钾氧化法:化学反应方程式为:6I2+11KClO3+3H2O=6KH(IO3)2+5KC1+3C12,每生成3mol KH(IO3)2,反应中转移的电子数为______,向反应后溶液中加______溶液得到KIO3。
(2)一种由含碘废水制取碘酸钾的工艺如图:

①进行“过滤1”时,需同时对CuI沉淀进行洗涤。在洗涤液中可通过滴加______盐溶液来检验其是否已洗涤干净。
②“制FeI2”时,发生反应的化学方程式为______。
③在KIO3、KHSO3的酸性混合溶液中加入少量KI(催化剂)和淀粉,不停地搅拌,反应机理为:第一步IO3-+5I-+6H+=3I2+3H2O第二步反应的离子方程式为______。
当反应进行到1.5min时,溶液突然变为蓝色,随之又很快消失,则第______步反应速率快。
④改变反应温度,重复上述实验,得到温度(T)与溶液变蓝所需时间(t)的关系如图所示(超过50℃后溶液不会再变蓝)。根据图象,请你分析温度低于50℃时,溶液变蓝所需时间与反应温度的关系:_________。

(3)山东省已下调食用盐碘含量标准每千克盐含碘25毫克(波动范围为18~33mgkg-1)。测定食盐试样中碘元素含量的步骤如下:称取4.000g市售食盐加入锥形瓶中,依次加入适量的水、稍过量KI及稀硫酸;充分反应后,再加入12.00mL6.000×10-4molL-1Na2S2O3溶液,与生成的碘恰好完全反应。有关反应原理为:
KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O;I2+2S2O32-=2I-+S4O62-。计算该食盐试样中碘元素的含量______mgkg-1。
【答案】30NA KOH BaCl2[或Ba(NO3)2] 2Cul +Fe =Fel2+2Cu I2 +HSO3- +H2O=2I- +SO42- +3H+ 二 温度低于30℃时,温度越高,溶液变蓝所需时间越短;温度高于30℃时,温度越高,溶液变蓝所需时间越长 38.10
【解析】
(1)根据化学反应方程式为:6I2+11KClO3+3H2O=6KH(IO3)2+5KC1+3C12,I2的化合价由0价到+5价,每生成6mol KH(IO3)2,反应中转移的电子数为60mol,则生成3mol KH(IO3)2转移的电子数为30mol即30NA。根据反应生成的产物KH(IO3)2,要制得KIO3,需向反应后溶液中加KOH溶液,发生的反应为KH(IO3)2+KOH= 2KIO3+H2O。答案:KOH。
(2)“过滤1”操作之前溶液中主要含有硫酸盐,所以只要洗涤滤液中没有SO42-,就表示沉淀已经洗涤干净,检验SO42-离子常用的试剂是BaCl2溶液等可溶性钡盐溶液和稀硝酸(或稀盐酸).答案:BaCl2或Ba(NO3)2。
②由流程图可知CuI 和Fe 可以“制FeI2”,发生反应的化学方程式为2CuI+Fe =FeI2 +2Cu。答案:2CuI+Fe =FeI2 +2Cu。
③在KIO3、KHSO3的酸性混合溶液中加入少量KI(催化剂)和淀粉,不停地搅拌,反应机理为:第一步IO3-+5I-+6H+=3I2+3H2O ,第二步反应的离子方程式为I2+HSO3-+H2O=2I-+SO42-+3H+。
当反应进行到1.5min时,溶液突然变为蓝色,随之又很快消失,说明第二步反应速率快。
④根据图像可知,温度低于30℃时,温度越高,溶液变蓝所需时间越短,说明催化剂的活性在30℃最好,且温度较高时化学反应速率较快;温度高于30℃时,温度越高,溶液变蓝所需时间越长。答案:温度低于30C时,温度越高,溶液变蓝所需时间越短;温度高于30C时,温度越高,溶液变蓝所需时间越长。
(5)根据题目提供的反应原理可KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O;I2+2S2O32-=2I-+S4O62-
KIO3![]() 3I2
3I2![]() S2O32-,n(I)=n(KIO3)=1/6n(S2O32-)=1/6
S2O32-,n(I)=n(KIO3)=1/6n(S2O32-)=1/6![]() 6.000
6.000![]() 10-4molL-1
10-4molL-1![]() 12.OOmL
12.OOmL![]() 10-3LmL-1=1.200
10-3LmL-1=1.200![]() 10-6mol,m(I)= 1.200
10-6mol,m(I)= 1.200![]() 10-6mol
10-6mol![]() 127gmol-1
127gmol-1![]() 103mgg-1=0.1524mg碘含量为:0.1524mg /(4.000g
103mgg-1=0.1524mg碘含量为:0.1524mg /(4.000g![]() 10-3kg/g)=38.10mg/kg。答案:38.10。
10-3kg/g)=38.10mg/kg。答案:38.10。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】根据能量变化示意图,下列说法正确的是( )

A. 状态1是液态,则状态3一定是气态
B. 状态3是液态,则状态4一定是气态
C. A(状态2)+B(g)═C(状态3)+D(g)△H=(d﹣a)kJmol﹣1
D. 断裂1molC(状态3)和1molD(g)中的化学键需要吸收的能量为(e﹣d)kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是氯化铯晶体的晶胞(晶体中的最小重复单元),已知晶体中两个最近的Cs+离子核间距离为a cm,氯化铯的相对分子质量为M,NA为阿伏加德罗常数,则氯化铯晶体密度是( )

A. ![]() g/cm3 B.
g/cm3 B. ![]() g/cm3 C.
g/cm3 C. ![]() g/cm3 D.
g/cm3 D. ![]() g/cm3
g/cm3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化碳的有效回收利用,既能缓解能源危机,又可减少温室效应的影响,具有解决能源问题及环保问题的双重意义。Zn/ZnO热化学循环还原CO2制CO的原理如下图所示,回答下列问题:

(1)①从循环结果看,能量转化的主要方式是______________ ;
②反应2CO2(g)=2CO(g)+O2(g) △H=_________kJ/mol。
③Zn/ZnO在反应中循环使用,其作用是__________________
(2)二甲醚是主要的有机物中间体,在一定条件下利用CO2与H2可直接合成二甲醚:2CO2(g) +6H2(g)![]() CH3OCH3(g)+3H2O(g) ,
CH3OCH3(g)+3H2O(g) ,![]() =3时,实验测得CO2的平衡转化率随温度及压强变化如下图所示。
=3时,实验测得CO2的平衡转化率随温度及压强变化如下图所示。
①该反应的△H =______0(填“>”或“<”)。
②图中压强(P)由大到小的顺序是__________________。
③若在1L密闭容器中充入0.2molCO2和0.6molH2,CO2的平衡转化率对应下图中A点,则在此温度,该反应的化学平衡常数是___________(保留整数)。
④合成二甲醚过程中往往会生成一氧化碳,合成时选用硅铝化合物做催化剂,硅铝比不同时,生成二甲醚或一氧化碳的物质的量分数不同。硅铝比与产物选择性如下图所示。图中A点和B点的化学平衡常数比较:KA____KB(填“>、<、=”)。根据以上两条曲线,写出其中一条变化规律:_______________________。

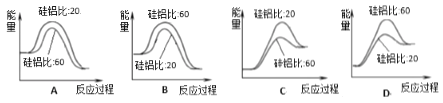
⑤上图是使用不同硅铝比化合物做催化剂制备二甲醚的能量变化示意图,其中正确且最佳的是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃、101 kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ,下列热化学方程式书写正确的是()
A. CH3OH(l)+3/2O2(g)![]() CO2(g)+2H2O(l) ΔH=+725.76 kJ·mol-1
CO2(g)+2H2O(l) ΔH=+725.76 kJ·mol-1
B. 2CH3OH(l)+3O2(g)![]() 2CO2(g)+4H2O(l) ΔH=-1 451.52 kJ·mol-1
2CO2(g)+4H2O(l) ΔH=-1 451.52 kJ·mol-1
C. 2CH3OH(l)+3O2(g)![]() 2CO2(g)+4H2O(l) ΔH=-725.76 kJ·mol-1
2CO2(g)+4H2O(l) ΔH=-725.76 kJ·mol-1
D. 2CH3OH(l)+3O2(g)![]() 2CO2(g)+4H2O(l)ΔH=+1451.52 kJ·mol-1
2CO2(g)+4H2O(l)ΔH=+1451.52 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 可用于治疗甲状腺疾病,其同位素原子可能
可用于治疗甲状腺疾病,其同位素原子可能
A. 质子数为78,中子数为53B. 质子数为54,中子数为131
C. 质子数为53,质量数为127D. 质子数为78,质量数为131
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示:

(1)①该反应是__________反应(填“吸热”或“放热”)。
②当反应达到平衡时,升高温度,A的转化率__________(填“增大”“减小”“不变”)。
③在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1__________,E2__________(填“增大”“减小”“不变”)。
(2)101 kPa时,1 mol H2完全燃烧生成液态水,放出285.8 kJ的热量,表示H2燃烧热的化学方程式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各物质所含原子个数按由大到小的顺序排列的是
①标况下11.2L NH3②1molHe③9gH2O④1.204×1023个H3PO4
A.①④③②B.④③②①C.②③④①D.①④②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】传统接触法制取硫酸能耗大,污染严将燃料电池引人硫酸生产工艺可有效解决能耗和环境污染问题,同时提供电能。以燃料电池为电源电解硫酸铜溶液的工作原理示意图如下所示。

下列说法不正确的是( )
A. b极为正极,电极反应式为O2+4H++4e-=2H20
B. H+由a极通过质子交换膜向b极移动
C. 该燃料电池的总反应式为2SO2+O2+2H2O=2H2SO4
D. 若a极消耗2.24 L(标准状况)SO2,理论上c极,有6.4g铜析出
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com