
【题目】如图所示:

(1)①该反应是__________反应(填“吸热”或“放热”)。
②当反应达到平衡时,升高温度,A的转化率__________(填“增大”“减小”“不变”)。
③在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1__________,E2__________(填“增大”“减小”“不变”)。
(2)101 kPa时,1 mol H2完全燃烧生成液态水,放出285.8 kJ的热量,表示H2燃烧热的化学方程式__________。
【答案】放热 减小 减小 减小 H2(g)+1/2O2(g)=H2O(l) ΔH=-285.8 kJ/mol
【解析】
(1) ①由图象可以知道该反应是一个能量降低的反应,所以属于放热反应,因此答案是:放热;
②由图知A(g)+B(g)=C(g)+D(g) ΔH<0,所以升高温度,平衡逆向移动,A的浓度增大,A的转化率减小,因此答案是:减小;
③加入催化剂改变了反应的途径,降低正逆反应所需的活化能,所以E1和E2的变化都减小,因此答案是:减小;减小;
(2) 燃烧热指1 mol可燃物完全燃烧生成稳定氧化物时放出的热量,所以表示H2燃烧热的化学方程式为H2(g)+1/2O2(g)=H2O(l) ΔH=-285.8 kJ/mol,故答案为:H2(g)+1/2O2(g)=H2O(l) ΔH=-285.8 kJ/mol。


科目:高中化学 来源: 题型:
【题目】如右图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中。下列分析正确的()
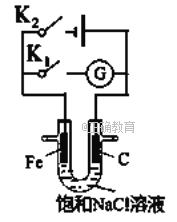
A. K1闭合,铁棒上发生的反应为2H++2e-=H2↑
B. K1闭合,石墨棒周围溶液碱性增强
C. K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法
D. K2闭合,电路中通过0.002NA个电子时,两极共产生0.001mol气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁氮化合物(FexNy)在磁记录材料领域有着广泛的应用前景。某FexNy的制备需铁、氮气、丙酮和乙醇参与。
(1)Fe基态原子结构示意图__________。
(2)丙酮( )分子中各元素电负性从大到小顺序是________,1 mol丙酮分子中含有σ键的数目为________。
)分子中各元素电负性从大到小顺序是________,1 mol丙酮分子中含有σ键的数目为________。
(3)某FexNy的晶胞如图1所示,Cu可以完全替代该晶体中a位置Fe或者b位置Fe,形成Cu替代型产物Fe(x-n)CunNy。FexNy转化为两种Cu替代型产物的能量变化如图2所示,其中更稳定的Cu替代型产物的化学式为________。


(4)科学家制得由20个碳原子组成的 空心笼状分子C20,该笼状结构是由许多正五边形构成(如图)。

请回答:一个 C20分子共有_______条棱边,推测C20晶体的硬度_______(填较大或较小)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KIO3是一种重要的无机化合物,可作为食盐中的补碘剂,常见制备方法如下。
(1)氯酸钾氧化法:化学反应方程式为:6I2+11KClO3+3H2O=6KH(IO3)2+5KC1+3C12,每生成3mol KH(IO3)2,反应中转移的电子数为______,向反应后溶液中加______溶液得到KIO3。
(2)一种由含碘废水制取碘酸钾的工艺如图:

①进行“过滤1”时,需同时对CuI沉淀进行洗涤。在洗涤液中可通过滴加______盐溶液来检验其是否已洗涤干净。
②“制FeI2”时,发生反应的化学方程式为______。
③在KIO3、KHSO3的酸性混合溶液中加入少量KI(催化剂)和淀粉,不停地搅拌,反应机理为:第一步IO3-+5I-+6H+=3I2+3H2O第二步反应的离子方程式为______。
当反应进行到1.5min时,溶液突然变为蓝色,随之又很快消失,则第______步反应速率快。
④改变反应温度,重复上述实验,得到温度(T)与溶液变蓝所需时间(t)的关系如图所示(超过50℃后溶液不会再变蓝)。根据图象,请你分析温度低于50℃时,溶液变蓝所需时间与反应温度的关系:_________。

(3)山东省已下调食用盐碘含量标准每千克盐含碘25毫克(波动范围为18~33mgkg-1)。测定食盐试样中碘元素含量的步骤如下:称取4.000g市售食盐加入锥形瓶中,依次加入适量的水、稍过量KI及稀硫酸;充分反应后,再加入12.00mL6.000×10-4molL-1Na2S2O3溶液,与生成的碘恰好完全反应。有关反应原理为:
KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O;I2+2S2O32-=2I-+S4O62-。计算该食盐试样中碘元素的含量______mgkg-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中的一定量混合气体发生反应:x A(g) + y B(g) ![]() z C(g),平衡时测得A的浓度为0.5 mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再次达到平衡时,测得A的浓度降低为0.3 mol/L,下列有关判断正确的是( )
z C(g),平衡时测得A的浓度为0.5 mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再次达到平衡时,测得A的浓度降低为0.3 mol/L,下列有关判断正确的是( )
A.x + y < z B.B的转化率降低
C.平衡向正反应方向移动 D.C的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1).对于下列反应:2SO2 + O2 ![]() 2SO3 , 如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为__________,用O2浓度变化来表示的反应速率为__________。
2SO3 , 如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为__________,用O2浓度变化来表示的反应速率为__________。
(2)反应N2+3H2![]() 2NH3 ΔH<0 ,达平衡后,不同时刻改变外界条件时正逆反应速率变化如图,请判断某时刻所改变的条件。
2NH3 ΔH<0 ,达平衡后,不同时刻改变外界条件时正逆反应速率变化如图,请判断某时刻所改变的条件。

可能改变的外界条件:t1__________,t2__________ ,t3__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前碘酸钾被广泛应用于食盐加碘。一种由含碘废水制取碘酸钾的工艺如下:
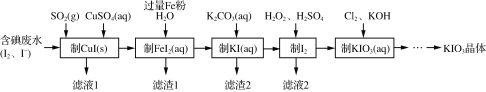
(1)检验“含碘废水”中是否含有单质I2,常用的试剂是________。
(2)通入SO2的目的是将I2还原为I-,该反应的离子方程式为__________________________________。
(3)滤渣1的成分为________。

(4)“制KI(aq)”时,Fe2+会水解形成胶状物吸附KI,造成I-的损失。已知此温度下,Kw=1.0×10-13,Ksp[Fe(OH)2]=9.0×10-15。现测得溶液中c(FeI2)为0.9 mol·L-1,为减少I-的损失,起始时,加入K2CO3必须保持FeI2溶液的pH不大于________。
(5)“制KIO3溶液”时,发生反应的离子方程式为_______________________________。
(6) KCl、KIO3的溶解度曲线如图所示。由KIO3溶液得到KIO3晶体的方法为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸和一水合氨是中学化学中常见的弱电解质。
(1)常温下,某研究性学习小组设计了如下方案证明醋酸为弱电解质,你认为方案可行的是_______(填序号)
①配制一定量的0.10 mol/L CH3COOH溶液,然后测溶液的pH,若pH大于1,则证明醋酸为弱电解质。
②用醋酸溶液和盐酸做导电性实验,若醋酸溶液导电性弱,则证明醋酸为弱电解质。
③将pH=2的CH3COOH溶液加水稀释100倍后,若pH>4,则证明醋酸为弱电解质。
④配制一定量的CH3COONa溶液,测其pH,若pH大于7,则证明醋酸为弱电解质。
(2)若25℃时,0.10 mol/L的CH3COOH的电离度为1%,则该溶液的pH=________,由醋酸电离出的c(H+)约为水电离出的c(H+)的_________倍。
(3)已知在25℃时,醋酸的电离平衡常数为Ka=1.8×10-5。常温下,0.1mol/LNaOH溶液V1 mL和0.2mol/LCH3COOH溶液V2 mL混合后(忽略混合前后溶液体积的变化)溶液的pH=7。
①反应后溶液中离子浓度的大小关系为_________________________________________________。
②V1:V2 __________(填“>”、“<”或“=”)2:1
③c(CH3COO-):c(CH3COOH)=__________________。
(4)常温下,可用氨水吸收废气中的CO2得到NH4HCO3溶液,在该溶液中,c(NH4+)_______(填“>”、“<”或“=”)c(HCO3-);反应NH4++HCO3-+H2O![]() NH3·H2O+H2CO3的平衡常数K=_________。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数Ka1=4×10-7,Ka2=4×10-11)
NH3·H2O+H2CO3的平衡常数K=_________。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数Ka1=4×10-7,Ka2=4×10-11)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰化钠是一种剧毒物质,工业上常用硫代硫酸钠溶液处理废水中的氰化钠。硫代硫酸钠的工业制备原理为:2Na2S+Na2CO3+4SO2===3Na2S2O3+CO2 。某化学兴趣小组拟用该原理在实验室制备硫代硫酸钠,并检测氰化钠废水处理排放情况。
I.实验室通过如图所示装置制备Na2S2O3
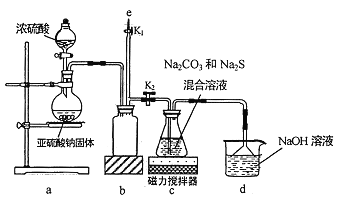
(1)实验中要控制SO2生成速率,可采取的措施有_____________(写出一条)。
(2)b装置的作用是_____________ 。
(3)反应开始后,c 中先有淡黄色浑浊产生,后又变为澄清,此浑浊物为__________(填化学式)。
(4)实验结束后,在e处最好连接盛__________(填“NaOH 溶液”、“水”、“CCl4”中的一种) 的注射器,接下来的操作为______________,最后拆除装置。
II.氰化钠废水处理
(5)已知: a.废水中氰化钠的最高排放标准为0.50mg/L;
b.Ag++2CN-==[Ag(CN)2]-,Ag++I-=AgI↓,AgI 呈黄色,且CN-优先与Ag+反应。
实验如下: 取20.00mL处理后的氰化钠废水于锥形瓶中,并滴加几滴KI溶液作指示剂,用1.00×10-4mol/L的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为1.50mL。
①滴定时1.00×10-4mol/L的标准AgNO3溶液应用________(填仪器名称) 盛装; 滴定终点时的现象是______________。
②处理后的废水是否达到排放标准_______(填“是”或“否”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com