
【题目】目前碘酸钾被广泛应用于食盐加碘。一种由含碘废水制取碘酸钾的工艺如下:
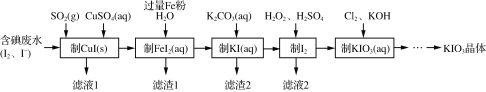
(1)检验“含碘废水”中是否含有单质I2,常用的试剂是________。
(2)通入SO2的目的是将I2还原为I-,该反应的离子方程式为__________________________________。
(3)滤渣1的成分为________。

(4)“制KI(aq)”时,Fe2+会水解形成胶状物吸附KI,造成I-的损失。已知此温度下,Kw=1.0×10-13,Ksp[Fe(OH)2]=9.0×10-15。现测得溶液中c(FeI2)为0.9 mol·L-1,为减少I-的损失,起始时,加入K2CO3必须保持FeI2溶液的pH不大于________。
(5)“制KIO3溶液”时,发生反应的离子方程式为_______________________________。
(6) KCl、KIO3的溶解度曲线如图所示。由KIO3溶液得到KIO3晶体的方法为___________________。
【答案】淀粉溶液 SO2+I2+2H2O===SO42-+2I-+4H+(或2SO2+I2+2Cu2++4H2O===2CuI↓+2SO42-+8H+) Fe、Cu 6.0 5Cl2+I2+12OH-===2IO3-+10Cl-+6H2O 蒸发浓缩,降温结晶
【解析】
由流程图可知,含碘废水通入SO2将I2还原为I-,Cu2+和I-发生反应生成CuI和I2,总反应为2SO2+I2+2Cu2++4H2O===2CuI↓+2SO42-+8H+,过滤后得到CuI固体;向CuI固体中加入Fe粉和水置换出铜并生成FeI2溶液,过滤后得到滤渣为过量的铁和生成的铜;向FeI2溶液中加入K2CO3溶液制取KI;在KI溶液中加入H2O2和H2SO4,将I-氧化为I2;I2和Cl2在碱性条件下反应生成KIO3,KIO3溶液通过蒸发浓缩,降温结晶得到KIO3晶体。
(1)碘与淀粉溶液变蓝,所以检验I2,常用的试剂是淀粉溶液,
故答案为:淀粉溶液;
(2)SO2将I2还原为I-,本身被氧化为SO42-,离子方程式为SO2+I2+2H2O===SO42-+2I-+4H+,
故答案为:SO2+I2+2H2O===SO42-+2I-+4H+;
(3)根据以上分析,滤渣1的成分为Fe、Cu,
故答案为:Fe、Cu;
(4)Fe2+会水解形成胶状物吸附KI,造成I-的损失,为减少I-的损失,防止生成Fe(OH)2,需要控制溶液的pH,根据Ksp[Fe(OH)2]=c(Fe2+)![]() c2(OH-)=9.0×10-15,得c(OH-)=
c2(OH-)=9.0×10-15,得c(OH-)=![]() =10-7mol/L,则c(H+)=
=10-7mol/L,则c(H+)=![]() =1.0
=1.0![]() 10-6mol/L,pH=-lg10-6=6.0,
10-6mol/L,pH=-lg10-6=6.0,
即加入K2CO3必须保持FeI2溶液的pH不大于6.0,
故答案为:6.0;
(5) I2和Cl2在碱性条件下反应生成KIO3,离子方程式为5Cl2+I2+12OH-===2IO3-+10Cl-+6H2O ,
故答案为:5Cl2+I2+12OH-===2IO3-+10Cl-+6H2O ;
(6) 由溶解度曲线可知KIO3在常温下的溶解度较小,故由KIO3溶液得到KIO3晶体的方法为蒸发浓缩,降温结晶,
故答案为:蒸发浓缩,降温结晶。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】根据能量变化示意图,下列说法正确的是( )

A. 状态1是液态,则状态3一定是气态
B. 状态3是液态,则状态4一定是气态
C. A(状态2)+B(g)═C(状态3)+D(g)△H=(d﹣a)kJmol﹣1
D. 断裂1molC(状态3)和1molD(g)中的化学键需要吸收的能量为(e﹣d)kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃、101 kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ,下列热化学方程式书写正确的是()
A. CH3OH(l)+3/2O2(g)![]() CO2(g)+2H2O(l) ΔH=+725.76 kJ·mol-1
CO2(g)+2H2O(l) ΔH=+725.76 kJ·mol-1
B. 2CH3OH(l)+3O2(g)![]() 2CO2(g)+4H2O(l) ΔH=-1 451.52 kJ·mol-1
2CO2(g)+4H2O(l) ΔH=-1 451.52 kJ·mol-1
C. 2CH3OH(l)+3O2(g)![]() 2CO2(g)+4H2O(l) ΔH=-725.76 kJ·mol-1
2CO2(g)+4H2O(l) ΔH=-725.76 kJ·mol-1
D. 2CH3OH(l)+3O2(g)![]() 2CO2(g)+4H2O(l)ΔH=+1451.52 kJ·mol-1
2CO2(g)+4H2O(l)ΔH=+1451.52 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示:

(1)①该反应是__________反应(填“吸热”或“放热”)。
②当反应达到平衡时,升高温度,A的转化率__________(填“增大”“减小”“不变”)。
③在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1__________,E2__________(填“增大”“减小”“不变”)。
(2)101 kPa时,1 mol H2完全燃烧生成液态水,放出285.8 kJ的热量,表示H2燃烧热的化学方程式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚乳酸E在服装、卫生医疗制品等行业具有广泛的应用。某有机化合物A在一定条件下通过一系列反应可合成E;同时还可得到C和D等重要有机化合物。转化关系如下图:

完成下列填空:
(1)B→E反应类型:_____________, D→G实验室中反应条件:________________。
(2)A的分子式:___________________。
(3)与F同类别的同分异构体还有HCOOCH(CH3)2 、HCOOCH2CH2CH3和______________(用结构简式表示)。
(4)写出实验室中判断D中有G生成的方法___________________________________________________ (5)石油产品丙烯及必要的无机试剂可合成丙烯酸,设计合成路线如下:CH3CH=CH2![]() ClCH2CH=CH2→甲→乙→丙
ClCH2CH=CH2→甲→乙→丙![]() 丙烯酸
丙烯酸
已知:
i.![]()
请完成合成路线中的:ClCH2CH=CH2→甲→乙→丙____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各物质所含原子个数按由大到小的顺序排列的是
①标况下11.2L NH3②1molHe③9gH2O④1.204×1023个H3PO4
A.①④③②B.④③②①C.②③④①D.①④②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )
A.  由图可知,2SO3(g)===2SO2(g)+O2(g) ΔH=(E1-E2)kJ·mol-1
由图可知,2SO3(g)===2SO2(g)+O2(g) ΔH=(E1-E2)kJ·mol-1
B.  表示Al3+与OH-反应时溶液中含铝微粒浓度变化曲线,a点溶液中存在大量Al3+
表示Al3+与OH-反应时溶液中含铝微粒浓度变化曲线,a点溶液中存在大量Al3+
C.  温度在T1和T2时水溶液中c(H+)和c(OH-)的关系,则阴影部分M内任意一点均满足c(H+)>c(OH-)
温度在T1和T2时水溶液中c(H+)和c(OH-)的关系,则阴影部分M内任意一点均满足c(H+)>c(OH-)
D.  表示反应N2(g)+3H2(g)=2NH3(g)平衡时NH3体积分数随起始n(N2)/n(H2)变化的曲线,则转化率:αA(H2)=αB(H2)
表示反应N2(g)+3H2(g)=2NH3(g)平衡时NH3体积分数随起始n(N2)/n(H2)变化的曲线,则转化率:αA(H2)=αB(H2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,等质量的CO和CO2相比,下列叙述中正确的是
A.所含碳原子数比为1:1 B.体积比为7:11
C.密度比为7:11 D.分子数比为7:11
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组对KSCN的性质进行探究,设计如下实验:
试管中试剂 | 实验 | 滴加试剂 | 现象 |
| Ⅰ | ⅰ.先加1mL 0.1 mol/L FeSO4溶液 ⅱ.再加硫酸酸化的KMnO4溶液 | ⅰ.无明显现象 ⅱ.先变红,后褪色 |
Ⅱ | ⅲ.先加1mL 0.05 mol/L Fe2(SO4)3溶液 ⅳ.再滴加0.5 mL 0.5 mol/L FeSO4溶液 | ⅲ.溶液变红 ⅳ.红色明显变浅 |
(1)SCN-存在两种结构式,分别为N≡C—S-和S=C=N-,SCN-是二者的互变异构的混合物,请写出N≡C—S-的电子式__________。
(2)用离子方程式表示FeSO4溶液显酸性的原因__________。
(3)①用离子方程式表示实验Ⅰ溶液变红的原因____________________________。

②针对实验Ⅰ中红色褪去的原因,小组同学认为是SCN-被酸性KMnO4氧化为SO42-,并设计如如图实验装置证实了猜想是成立的。其中X溶液是_______,Y溶液是_______,检验产物SO42-的操作及现象是_____________。
(4)针对实验Ⅱ“红色明显变浅”的现象,实验小组进行探究。
甲同学查资料得知:当加入强电解质后,增大了离子间相互作用,离子之间牵制作用增强,即“盐效应”。“盐效应”使Fe3++SCN-![]() [Fe(SCN)]2+平衡体系中的Fe3+跟SCN-结合成[Fe(SCN)]2+的机会减少,溶液红色变浅。
[Fe(SCN)]2+平衡体系中的Fe3+跟SCN-结合成[Fe(SCN)]2+的机会减少,溶液红色变浅。
乙同学认为SCN-可以与Fe2+反应生成无色络合离子,进一步使Fe3++SCN-![]() [Fe(SCN)]2+平衡左移,红色明显变浅,而Mg2+与SCN-难络合,于是乙设计了如下实验:
[Fe(SCN)]2+平衡左移,红色明显变浅,而Mg2+与SCN-难络合,于是乙设计了如下实验:

由此推测,实验Ⅱ“红色明显变浅”的原因是___________________。
(5)工业上测定钛铁合金中钛含量的其中一步反应原理是:以KSCN为指示剂,用NH4Fe(SO4)2标准溶液滴定Ti(Ⅲ),反应的化学方程式为:Ti2(SO4)3+2NH4Fe(SO4)2===2Ti(SO4)2+(NH4)2SO4+2FeSO4,则达到滴定终点的实验现象是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com