
【题目】某实验小组对KSCN的性质进行探究,设计如下实验:
试管中试剂 | 实验 | 滴加试剂 | 现象 |
| Ⅰ | ⅰ.先加1mL 0.1 mol/L FeSO4溶液 ⅱ.再加硫酸酸化的KMnO4溶液 | ⅰ.无明显现象 ⅱ.先变红,后褪色 |
Ⅱ | ⅲ.先加1mL 0.05 mol/L Fe2(SO4)3溶液 ⅳ.再滴加0.5 mL 0.5 mol/L FeSO4溶液 | ⅲ.溶液变红 ⅳ.红色明显变浅 |
(1)SCN-存在两种结构式,分别为N≡C—S-和S=C=N-,SCN-是二者的互变异构的混合物,请写出N≡C—S-的电子式__________。
(2)用离子方程式表示FeSO4溶液显酸性的原因__________。
(3)①用离子方程式表示实验Ⅰ溶液变红的原因____________________________。

②针对实验Ⅰ中红色褪去的原因,小组同学认为是SCN-被酸性KMnO4氧化为SO42-,并设计如如图实验装置证实了猜想是成立的。其中X溶液是_______,Y溶液是_______,检验产物SO42-的操作及现象是_____________。
(4)针对实验Ⅱ“红色明显变浅”的现象,实验小组进行探究。
甲同学查资料得知:当加入强电解质后,增大了离子间相互作用,离子之间牵制作用增强,即“盐效应”。“盐效应”使Fe3++SCN-![]() [Fe(SCN)]2+平衡体系中的Fe3+跟SCN-结合成[Fe(SCN)]2+的机会减少,溶液红色变浅。
[Fe(SCN)]2+平衡体系中的Fe3+跟SCN-结合成[Fe(SCN)]2+的机会减少,溶液红色变浅。
乙同学认为SCN-可以与Fe2+反应生成无色络合离子,进一步使Fe3++SCN-![]() [Fe(SCN)]2+平衡左移,红色明显变浅,而Mg2+与SCN-难络合,于是乙设计了如下实验:
[Fe(SCN)]2+平衡左移,红色明显变浅,而Mg2+与SCN-难络合,于是乙设计了如下实验:

由此推测,实验Ⅱ“红色明显变浅”的原因是___________________。
(5)工业上测定钛铁合金中钛含量的其中一步反应原理是:以KSCN为指示剂,用NH4Fe(SO4)2标准溶液滴定Ti(Ⅲ),反应的化学方程式为:Ti2(SO4)3+2NH4Fe(SO4)2===2Ti(SO4)2+(NH4)2SO4+2FeSO4,则达到滴定终点的实验现象是______。
【答案】![]() Fe2++2H2O
Fe2++2H2O![]() Fe(OH)2 + 2H+ MnO4—+ 5Fe2+ + 8H+ = Mn2++ 5Fe3+ + 4H2O,Fe3+ +3SCN—
Fe(OH)2 + 2H+ MnO4—+ 5Fe2+ + 8H+ = Mn2++ 5Fe3+ + 4H2O,Fe3+ +3SCN—![]() Fe(SCN)3 0.1 mol/L KSCN溶液 硫酸酸化的KMnO4溶液 一段时间后取少量反应后的KSCN溶液,先加盐酸酸化,再加氯化钡溶液,出现白色沉淀 水溶液的稀释使溶液变浅;“盐效应”使Fe3+跟SCN—结合成[Fe(SCN)] 2+的机会减少;SCN—与Fe2+反应生成无色络合离子,三者可能均有 无色变为红色或溶液变红
Fe(SCN)3 0.1 mol/L KSCN溶液 硫酸酸化的KMnO4溶液 一段时间后取少量反应后的KSCN溶液,先加盐酸酸化,再加氯化钡溶液,出现白色沉淀 水溶液的稀释使溶液变浅;“盐效应”使Fe3+跟SCN—结合成[Fe(SCN)] 2+的机会减少;SCN—与Fe2+反应生成无色络合离子,三者可能均有 无色变为红色或溶液变红
【解析】
(1)根据结构式即可写电子式;
(2)考查盐类水解;
(3)探究溶液变红后褪色原因,先变红是Fe2+氧化为Fe3+,Fe3+再与SCN—结合生成Fe(SCN)3。后褪色设计成原电池,从电子转移方向可判断正负极,结合化合价改变可判断电解质溶液;
(4)结合实验现象可知三次颜色都变浅,即都有关系;
(5)滴定终点会有铁离子,能跟指示剂反应。
(1)根据结构式N≡C—S-,可知电子式为![]() ;
;
(2)FeSO4是强酸弱碱盐,显酸性的原因是Fe2+的水解,离子方程式为:Fe2++2H2O![]() Fe(OH)2 + 2H+;
Fe(OH)2 + 2H+;
(3)①KMnO4将Fe2+氧化为Fe3+,Fe3+再与SCN—结合生成Fe(SCN)3,溶液变红,离子方程式为MnO4—+ 5Fe2+ + 8H+ = Mn2++ 5Fe3+ + 4H2O,Fe3+ +3SCN—![]() Fe(SCN)3;
Fe(SCN)3;
②探究SCN-是否被酸性KMnO4氧化为SO42-,设计成原电池,由电子转移方向可知,X溶液所处电极为负极,化合价升高,失去电子。故X溶液是0.1 mol/L KSCN溶液,Y溶液是硫酸酸化的KMnO4溶液。检验产物SO42-的操作及现象是:一段时间后取少量反应后的KSCN溶液,先加盐酸酸化,再加氯化钡溶液,出现白色沉淀;
(4)由三次加入试剂颜色均会变浅且一次比一次更浅可知,实验Ⅱ“红色明显变浅”的原因是水溶液的稀释使溶液变浅;“盐效应”使Fe3+跟SCN—结合成[Fe(SCN)] 2+的机会减少;SCN—与Fe2+反应生成无色络合离子,三者可能均有。
(5)以KSCN为指示剂,用NH4Fe(SO4)2标准溶液滴定Ti(Ⅲ),反应的化学方程式为:Ti2(SO4)3+2NH4Fe(SO4)2===2Ti(SO4)2+(NH4)2SO4+2FeSO4,滴定终点有:Fe3+ +3SCN—![]() Fe(SCN)3,则达到滴定终点的实验现象是无色变为红色或溶液变红。
Fe(SCN)3,则达到滴定终点的实验现象是无色变为红色或溶液变红。


科目:高中化学 来源: 题型:
【题目】目前碘酸钾被广泛应用于食盐加碘。一种由含碘废水制取碘酸钾的工艺如下:
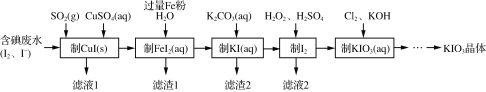
(1)检验“含碘废水”中是否含有单质I2,常用的试剂是________。
(2)通入SO2的目的是将I2还原为I-,该反应的离子方程式为__________________________________。
(3)滤渣1的成分为________。

(4)“制KI(aq)”时,Fe2+会水解形成胶状物吸附KI,造成I-的损失。已知此温度下,Kw=1.0×10-13,Ksp[Fe(OH)2]=9.0×10-15。现测得溶液中c(FeI2)为0.9 mol·L-1,为减少I-的损失,起始时,加入K2CO3必须保持FeI2溶液的pH不大于________。
(5)“制KIO3溶液”时,发生反应的离子方程式为_______________________________。
(6) KCl、KIO3的溶解度曲线如图所示。由KIO3溶液得到KIO3晶体的方法为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LiH2PO4是制备电池的重要原料。室温下,LiH2PO4溶液的pH随c初始(H2PO4–)的变化如图1所示,H3PO4溶液中H2PO4–的分布分数δ随pH的变化如图2所示,[![]() ]下列有关LiH2PO4溶液的叙述正确的是
]下列有关LiH2PO4溶液的叙述正确的是


A. 溶液中存在3个平衡
B. 含P元素的粒子有H2PO4–、HPO42–、PO43–
C. 随c初始(H2PO4–)增大,溶液的pH明显变小
D. 用浓度大于1 mol·L-1的H3PO4溶液溶解Li2CO3,当pH达到4.66时,H3PO4几乎全部转化为LiH2PO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰化钠是一种剧毒物质,工业上常用硫代硫酸钠溶液处理废水中的氰化钠。硫代硫酸钠的工业制备原理为:2Na2S+Na2CO3+4SO2===3Na2S2O3+CO2 。某化学兴趣小组拟用该原理在实验室制备硫代硫酸钠,并检测氰化钠废水处理排放情况。
I.实验室通过如图所示装置制备Na2S2O3
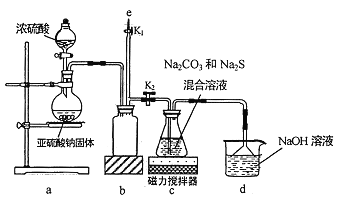
(1)实验中要控制SO2生成速率,可采取的措施有_____________(写出一条)。
(2)b装置的作用是_____________ 。
(3)反应开始后,c 中先有淡黄色浑浊产生,后又变为澄清,此浑浊物为__________(填化学式)。
(4)实验结束后,在e处最好连接盛__________(填“NaOH 溶液”、“水”、“CCl4”中的一种) 的注射器,接下来的操作为______________,最后拆除装置。
II.氰化钠废水处理
(5)已知: a.废水中氰化钠的最高排放标准为0.50mg/L;
b.Ag++2CN-==[Ag(CN)2]-,Ag++I-=AgI↓,AgI 呈黄色,且CN-优先与Ag+反应。
实验如下: 取20.00mL处理后的氰化钠废水于锥形瓶中,并滴加几滴KI溶液作指示剂,用1.00×10-4mol/L的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为1.50mL。
①滴定时1.00×10-4mol/L的标准AgNO3溶液应用________(填仪器名称) 盛装; 滴定终点时的现象是______________。
②处理后的废水是否达到排放标准_______(填“是”或“否”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,将22.4LHCl完全溶于1L水中(水的密度近似为1g/mL),溶液的密度为ρg/cm3(ρ>1),溶液的体积为VmL,溶质的质量分数为w,溶质的物质的量浓度为c mol/L。下列叙述中正确的是
①w=![]() ×100% ②c=1molL﹣1 ③向上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5w④向上述溶液中再加入VmL水后,所得溶液的质量分数小于0.5w
×100% ②c=1molL﹣1 ③向上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5w④向上述溶液中再加入VmL水后,所得溶液的质量分数小于0.5w
A.①②B.②③C.①③D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两个密闭容器中,分别充满等物质的量的甲、乙两种气体,它们的温度和摩尔质量均相同。试根据甲、乙的密度(ρ)的关系,下列说法中正确的是
A. 若ρ(甲)>ρ(乙),则气体体积:甲<乙
B. 若ρ(甲)>ρ(乙),则分子数:甲>乙
C. 若ρ(甲)<ρ(乙),则气体摩尔体积:甲<乙
D. 若ρ(甲)<ρ(乙),则气体的压强:甲>乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二茂铁可用作燃料的节能消烟剂、抗爆剂等。实验室制备二茂铁装置示意图如图

已知:①二茂铁熔点是173℃,在100℃时开始升华;沸点是249℃。
②制备二茂铁的反应原理是:2KOH+FeCl2+2C5H6=Fe(C5H5)2+2KCl+2H2O
实验步骤为:
①在三颈烧瓶中加入25g粉末状的KOH,并从仪器a中加入60mL无水乙醚到 烧瓶中,充分搅拌,同时通氮气约l0min;
②再从仪器a滴入5.5mL新蒸馏的环戊二烯(C5H6质量为5.225g),搅拌;
③将足量的无水FeCl2(CH3)2SO(二甲亚砜,作溶剂〕配成的溶液25mL装入仪器a中,慢慢滴入仪器c中,继续搅拌45min;
④再从仪器a加入25mL无水乙醚搅拌;
⑤将c中的液体转入分液漏斗中,依次用盐酸、水各洗涤两次,分液得橙黄色溶液;
⑥蒸发橙黄色溶液,得二茂铁粗产品。
回答下列问题:
(1)仪器b的名称是______________。
(2)步骤①中通入氮气的目的是______________。
(3)步骤⑤用盐酸洗涤的目的是______________。
(4)步骤⑦是二茂铁粗产品的提纯,该过程在下图中进行,其操作名称为_____________;该操作中棉花的作用是______________。

(5)为了确认得到的是二茂铁,还需要进行的一项简单实验是_____________________;若最终制得纯净的二茂铁4.3g,则该实验的产率为_____________(保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,一定条件下进行如下反应:NO(g)+CO(g)![]() 1/2N2(g)+CO2(g)△H=-373.2KJ/mol,达到平衡后,为提高NO的转化率和该反应的速率,可采取的措施是
1/2N2(g)+CO2(g)△H=-373.2KJ/mol,达到平衡后,为提高NO的转化率和该反应的速率,可采取的措施是
A. 加催化剂同时升高温度
B. 加催化剂同时增大压强
C. 升高温度同时充入N2
D. 降低温度同时增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)过氧化钙稳定性好、无毒,是一种应用广泛的多功能无机过氧化物。CaO2和Na2O2在结构和性质上有很多相似的地方。
①CaO2属于_____(填“离子化合物”或“共价化合物”),其电子式为____。
②氧元素位于元素周期表中第___周期第___族;钙原子最外电子层的符号为____。
(2)下述物质①葡萄糖②植物油③淀粉④聚乙烯中,属于糖类的是____;属于高分子化合物的是____;能水解的是____。
(3)实验室制备少量乙酸乙酯的装置如图所示,则②号试管中所用试剂为_____,反应结束后,分离乙酸乙酯的方法为____。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com