
【题目】(1)过氧化钙稳定性好、无毒,是一种应用广泛的多功能无机过氧化物。CaO2和Na2O2在结构和性质上有很多相似的地方。
①CaO2属于_____(填“离子化合物”或“共价化合物”),其电子式为____。
②氧元素位于元素周期表中第___周期第___族;钙原子最外电子层的符号为____。
(2)下述物质①葡萄糖②植物油③淀粉④聚乙烯中,属于糖类的是____;属于高分子化合物的是____;能水解的是____。
(3)实验室制备少量乙酸乙酯的装置如图所示,则②号试管中所用试剂为_____,反应结束后,分离乙酸乙酯的方法为____。

【答案】离子化合物 ![]() 二 VIA N ①③ ③④ ②③ 饱和碳酸钠溶液 分液
二 VIA N ①③ ③④ ②③ 饱和碳酸钠溶液 分液
【解析】
(1)①CaO2和Na2O2在结构和性质上有很多相似的地方,均含有过氧根离子,均为离子化合物,其电子式为![]() ;
;
②氧元素位于元素周期表中第二周期第VIA族,钙原子最外电子层为第四层,符号为N;
(2)①葡萄糖为单糖,不能水解②植物油为酯类,可以水解③淀粉为多糖,且为高分子化合物,可以水解④聚乙烯为聚合物且不能水解;故属于糖类的是①③,属于高分子化合物的是③④,能水解的是②③;
(3)②号试管中所用试剂为饱和碳酸钠溶液,可以吸收体系中挥发出的乙醇和乙酸,同时能降低乙酸乙酯的溶解度,反应结束后,乙酸乙酯在碳酸钠溶液的上层,分离乙酸乙酯的方法为分液。


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
【题目】某实验小组对KSCN的性质进行探究,设计如下实验:
试管中试剂 | 实验 | 滴加试剂 | 现象 |
| Ⅰ | ⅰ.先加1mL 0.1 mol/L FeSO4溶液 ⅱ.再加硫酸酸化的KMnO4溶液 | ⅰ.无明显现象 ⅱ.先变红,后褪色 |
Ⅱ | ⅲ.先加1mL 0.05 mol/L Fe2(SO4)3溶液 ⅳ.再滴加0.5 mL 0.5 mol/L FeSO4溶液 | ⅲ.溶液变红 ⅳ.红色明显变浅 |
(1)SCN-存在两种结构式,分别为N≡C—S-和S=C=N-,SCN-是二者的互变异构的混合物,请写出N≡C—S-的电子式__________。
(2)用离子方程式表示FeSO4溶液显酸性的原因__________。
(3)①用离子方程式表示实验Ⅰ溶液变红的原因____________________________。

②针对实验Ⅰ中红色褪去的原因,小组同学认为是SCN-被酸性KMnO4氧化为SO42-,并设计如如图实验装置证实了猜想是成立的。其中X溶液是_______,Y溶液是_______,检验产物SO42-的操作及现象是_____________。
(4)针对实验Ⅱ“红色明显变浅”的现象,实验小组进行探究。
甲同学查资料得知:当加入强电解质后,增大了离子间相互作用,离子之间牵制作用增强,即“盐效应”。“盐效应”使Fe3++SCN-![]() [Fe(SCN)]2+平衡体系中的Fe3+跟SCN-结合成[Fe(SCN)]2+的机会减少,溶液红色变浅。
[Fe(SCN)]2+平衡体系中的Fe3+跟SCN-结合成[Fe(SCN)]2+的机会减少,溶液红色变浅。
乙同学认为SCN-可以与Fe2+反应生成无色络合离子,进一步使Fe3++SCN-![]() [Fe(SCN)]2+平衡左移,红色明显变浅,而Mg2+与SCN-难络合,于是乙设计了如下实验:
[Fe(SCN)]2+平衡左移,红色明显变浅,而Mg2+与SCN-难络合,于是乙设计了如下实验:

由此推测,实验Ⅱ“红色明显变浅”的原因是___________________。
(5)工业上测定钛铁合金中钛含量的其中一步反应原理是:以KSCN为指示剂,用NH4Fe(SO4)2标准溶液滴定Ti(Ⅲ),反应的化学方程式为:Ti2(SO4)3+2NH4Fe(SO4)2===2Ti(SO4)2+(NH4)2SO4+2FeSO4,则达到滴定终点的实验现象是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液。其导电能力随滴入溶液体积变化的曲线如下图所示。请回答下列问题。
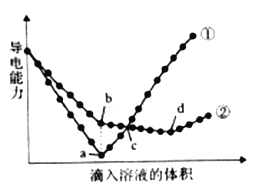
(1)写出NaHSO4溶液中,NaHSO4的电离方程式____________________。
(2)图中①、②分别代表滴加哪种溶液的变化曲线①_______、②______。
(3)b点,溶液中大量存在的离子是_________。
(4)曲线②中d点导电能力最弱的原因是____________________ (用化学方程式表示)。
(5)c点,两溶液中含有相同量的哪种离子______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知断开1molH2(g)中H-H键需要吸收436kJ能量,根据能量变化示意图,下列说法或热化学方程式不正确的是( )

A. 断开1molHCl(g)中H-Cl键要吸收432kJ能量
B. 生成1molCl2(g)中的Cl-Cl键放出243kJ能量
C. HCl(g)→1/2H2(g)+1/2Cl2(g)-92.5kJ
D. H2(g)+Cl2(g)→2HCl(g)+864kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L容积不变的容器中,发生N2+3H2 ![]() 2NH3的反应。现通入4 mol H2和4 mol N2,10 s内用H2表示的反应速率为0.12 mol/(L·s),则10 s后容器中N2的物质的量是
2NH3的反应。现通入4 mol H2和4 mol N2,10 s内用H2表示的反应速率为0.12 mol/(L·s),则10 s后容器中N2的物质的量是
A. 1.6 mol B. 2.8 mol
C. 3.2 mol D. 3.6 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物a和苯通过反应合成b的过程可表示为下图(无机小分子产物略去)。下列说法错误的是

A. 该反应是取代反应
B. 若R为—CH3时,b中所有碳原子共面
C. 若R为—C4H9时,则b中苯环上的一氯代物可能的结构共有12种
D. 若R为—C4H5O时,1mol b最多可以与4molH2加成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业以软锰矿(主要成分是MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料制备高性能的磁性材料碳酸锰(MnCO3)。其工业流程如下:

(1)浸锰过程中Fe2O3与SO2反应的离子方程式为Fe2O3+SO2+2H+=2Fe2++SO42-+H2O,该反应是经历以下两步反应实现的。
i.Fe2O3+6H+=2Fe3++3H2O ii.……
写出ii的离子方程式:______________________。
(2)过滤Ⅰ所得滤液中主要存在的两种金属阳离子为___________(填离子符号)
(3)氧化过程中被MnO2氧化的物质有(写化学式):______________________。
(4)“浸锰”反应中往往有副产物MnS2O6生成,温度对浸锰”反应的影响如图所示:为减少MnS2O6的生成,“浸锰”的适宜温度是___________;向过滤Ⅱ所得的滤液中加入NH4HCO3溶液时温度不宜太高的原因是______________________。

(5)加入NH4HCO3溶液后,生成MnCO3沉淀,同时还有气体生成,写出反应的离子方程式:______________________。
(6)已知:pNi=-lgc(Ni2+),常温下,Ksp(NiCO3)=1.4×10-7,向10mL0.1mol·L-1Ni(NO3)2溶液中滴加0.1mol·L-1Na2S溶液,会产生NiS沉淀,在滴加过程中pNi与Na2S溶液体积的关系如图所示。则在E、F、G三点中,___________点对应溶液中水电离程度最小,常温下,在NiS和NiCO3的浊液中![]() =______________________。
=______________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物中间体Q、医用材料PVA的合成路线如下。

已知:![]()
(1)A的分子式是C6H6,A→B的反应类型是_______。
(2)B→C是硝化反应,试剂a是_______。
(3)C→D为取代反应,其化学方程式是_______。
(4)E的结构简式是_______。
(5)F含有的官能团是________。
(6)G→X的化学方程式是________。
(7)W能发生聚合反应,形成的高分子结构简式是________。
(8)将下列E +W→Q的流程图补充完整(在虚线框内写出物质的结构简式):__________________

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】许多含氮物质是农作物生长的营养物质。
(1)肼(N2H4)、N2O4常用于航天火箭的发射。已知下列反应:
①N2(g)+O2(g) =2NO(g) ΔH=+180kJ·mol-1
②2NO(g)+O2(g)![]() 2NO2(g) ΔH=-112kJ·mol-1
2NO2(g) ΔH=-112kJ·mol-1
③2NO2(g)![]() N2O4(g) ΔH=-57kJ·mol-1
N2O4(g) ΔH=-57kJ·mol-1
④2N2H4(g)+N2O4(g) =3N2(g)+4H2O(g) ΔH=-1136kJ·mol-1
则N2H4与O2反应生成氮气与水蒸气的热化学方程式为_________________。
(2)一定温度下,向某密闭容器中充入1 mol NO2,发生反应:2NO2(g)![]() N2O4(g),测得反应体系中气体体积分数与压强之间的关系如图所示:
N2O4(g),测得反应体系中气体体积分数与压强之间的关系如图所示:
①a、b、c三点逆反应速率由大到小的顺序为_______。平衡时若保持压强、温度不变,再向体系中加入一定量的Ne,则平衡_______移动(填“正向”“逆向”或“不”)。
②a点时NO2的转化率为___________,用平衡分压代替平衡浓度也可求出平衡常数Kp,则该温度下Kp=________Pa-1。
(3)已知在一定温度下的可逆反应N2O4(g)![]() 2NO2(g)中,v正=k正c(N2O4),v逆=k逆c2(NO2)(k正、k逆只是温度的函数)。若该温度下的平衡常数K=10,则k正=______k逆。升高温度,k正增大的倍数_______(填“大于”“小于”或“等于”)k逆增大的倍数。
2NO2(g)中,v正=k正c(N2O4),v逆=k逆c2(NO2)(k正、k逆只是温度的函数)。若该温度下的平衡常数K=10,则k正=______k逆。升高温度,k正增大的倍数_______(填“大于”“小于”或“等于”)k逆增大的倍数。
(4)氨气是合成众多含氮物质的原料,利用H2-N2—生物燃料电池,科学家以固氮酶为正极催化剂、氢化酶为负极催化剂,X交换膜为隔膜,在室温条件下即实现了合成NH3的同时还获得电能。其工作原理图如下:

则X膜为___________交换膜,正极上的电极反应式为______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com