
【题目】药物中间体Q、医用材料PVA的合成路线如下。

已知:![]()
(1)A的分子式是C6H6,A→B的反应类型是_______。
(2)B→C是硝化反应,试剂a是_______。
(3)C→D为取代反应,其化学方程式是_______。
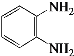
(4)E的结构简式是_______。
(5)F含有的官能团是________。
(6)G→X的化学方程式是________。
(7)W能发生聚合反应,形成的高分子结构简式是________。
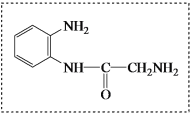
(8)将下列E +W→Q的流程图补充完整(在虚线框内写出物质的结构简式):__________________

【答案】取代反应 浓硫酸、浓硝酸 ![]()
 碳碳双键、酯基
碳碳双键、酯基 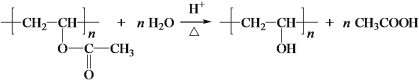
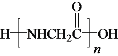
【解析】
这道题要结合题干中的问题才能得到相关信息。A为C6H6,为苯,和Cl2生成氯苯。B生成C是硝化反应,试剂a为浓硫酸和浓硝酸。C→D为取代反应,结合产物没有氯原子,则—NH2取代-Cl,接下来为-NO2还原成-NH2。F→G,为加聚,PVA中有醇羟基,可推导出G中含有酯基。可知X为乙酸。乙酸中甲基上的H被Cl取代,再被—NH2取代。
(1)类似于生成溴苯,苯在氯化铁做催化剂的作用下,与氯气反应生成氯苯,为取代反应,答案为取代反应;
(2)B→C是硝化反应,硝化反应的条件为浓硫酸、浓硝酸,加热,试剂a为浓硝酸和浓硫酸,答案为浓硝酸、浓硫酸;
(3)C→D为取代反应,结合产物没有氯原子,则—NH2取代-Cl,答案为![]() ;
;
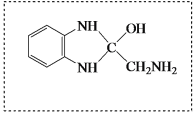
(4)A为苯,和Cl2生成氯苯。B生成C是硝化反应,在苯环上引入硝基。C→D为取代反应,—NH2取代-Cl,接下来为-NO2还原成-NH2。结合产物,E为邻苯二胺,可写出其结构式,答案为 ;
;
(5)F能够生成高分子化合物, 结合PVA的结构简式, F中有碳碳双键。结合产物PVA和X,G能够发生水解反应,有酯基,则F的官能团中也有酯基,答案为碳碳双键、酯基;
(6)G→X为酯的水解,X为乙酸,G水解得到PVA和乙酸,方程式为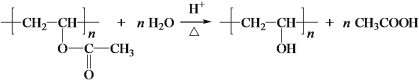 ;
;
(7)X为乙酸。乙酸中甲基上的H被Cl取代,再被—NH2取代。W中有氨基和羧基,可以发生缩聚反应,发生反应时,-NH2断开N-H键,—COOH断开C-O单键,脱去—OH,则W的结构简式为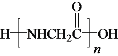 ;
;
(8)E和W第一步反应失去1分子水,E中只有氨基,W中有羧基和氨基,只能是羧基和氨基形成肽键。第一个中间体为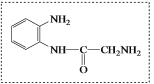 ;从第一个中间体的结构可知,有羰基,根据已知氨基可以与羰基反应,第二个中间体利用已知反应可知,为
;从第一个中间体的结构可知,有羰基,根据已知氨基可以与羰基反应,第二个中间体利用已知反应可知,为 ,再脱水可以得到产物,答案为
,再脱水可以得到产物,答案为
 ;
;


 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:
【题目】在密闭容器中,一定条件下进行如下反应:NO(g)+CO(g)![]() 1/2N2(g)+CO2(g)△H=-373.2KJ/mol,达到平衡后,为提高NO的转化率和该反应的速率,可采取的措施是
1/2N2(g)+CO2(g)△H=-373.2KJ/mol,达到平衡后,为提高NO的转化率和该反应的速率,可采取的措施是
A. 加催化剂同时升高温度
B. 加催化剂同时增大压强
C. 升高温度同时充入N2
D. 降低温度同时增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)过氧化钙稳定性好、无毒,是一种应用广泛的多功能无机过氧化物。CaO2和Na2O2在结构和性质上有很多相似的地方。
①CaO2属于_____(填“离子化合物”或“共价化合物”),其电子式为____。
②氧元素位于元素周期表中第___周期第___族;钙原子最外电子层的符号为____。
(2)下述物质①葡萄糖②植物油③淀粉④聚乙烯中,属于糖类的是____;属于高分子化合物的是____;能水解的是____。
(3)实验室制备少量乙酸乙酯的装置如图所示,则②号试管中所用试剂为_____,反应结束后,分离乙酸乙酯的方法为____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中的颜色变化,与氧化还原反应无关的是
A. FeCl3溶液滴入Mg(OH)2浊液中,白色浑浊转化为红褐色沉淀
B. AgNO3溶液滴入氯水中,产生白色沉淀,随后淡黄绿色褪去
C. Na块放在坩埚里并加热,发出黄色火焰,生成淡黄色固体
D. H2C2O4溶液滴入KMnO4酸性溶液中,产生气泡,随后紫色褪去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,对于可逆反应X(g) + 3Y(g) ![]() 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol/L、0.3 mol/L、0.08 mol/L,则下列判断不正确的是( )
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol/L、0.3 mol/L、0.08 mol/L,则下列判断不正确的是( )
A. c1:c2 = 1:3 B. 平衡时,Y和Z的生成速率之比为3:2
C. X、Y的转化率相等 D. c3的取值范围为0 mol/L < c3 < 0.14 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用等物质的量的反应物在恒容容器中模拟工业生产SO3,得到三组实验数据如下表所示:
实验 序号 | 温度 (℃) | SO2浓度(mo1/L) | ||||||
0min | 10min | 20min | 30min | 40min | 50min | 60min | ||
1 | 300 | 2.00 | 1.70 | 1.50 | 1.36 | 1.25 | 1.20 | 1.20 |
2 | 300 | 2.00 | 1.50 | 1.28 | 1.20 | 1.20 | 1.20 | 1.20 |
3 | 500 | 2.00 | 1.60 | 1.39 | 1.29 | 1.27 | 1.27 | 1.27 |
(1)实验1中,50~60mn时间段,SO2浓度均为1.20mo1/L的原因是___。
(2)实验2中,前20min内以O2的浓度变化表示的化学反应速率为___。
(3)三组实验中,只有1、2中的某组使用了催化剂,则使用催化剂的为第___组,分析实验1、2中的数据,你认为催化剂___(填“能”或“不能”)改变SO2的平衡转化率,理由是___。
(4)分析表格中的数据,温度升高,SO2的平衡转化率会___(填“增大”“不变”或“减小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生欲用已知物质的量浓度的盐酸测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂。请填写下列空白:
(1)用标准的盐酸滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶中颜色变化,直到加入一滴盐酸,溶液的颜色由____色变为_____,且半分钟不褪色,即停止滴定。
(2)下列操作中使所测氢氧化钠溶液的浓度数值偏高的是________(填序号)。

A、酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸
B、滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后未干燥
C、酸式滴定管在滴定前有气泡,滴定后气泡消失
D、读取盐酸体积时,开始俯视读数,滴定结束时仰视读数
E、滴定过程中,锥形瓶的振荡过于激烈,使少量溶液溅出
(3)若滴定开始和结束时,酸式滴定管中的液面如右图所示:则起始读数为_____mL,终点读数为_____mL。
(4)如已知用c(HCl) = 0.1000 mol/L的盐酸滴定20.00 mL的氢氧化钠溶液,测得的实验数据如(3)中记录所示,则该氢氧化钠溶液的浓度c(NaOH) =____mo1/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为证明乙烯能被酸性KMnO4溶液氧化,某小组按下图装置制备乙烯并检验其化学性质。完成下列填空:

(1)首先检验该装置气密性。检验气密性的操作是:_____________。
(2)向圆底烧瓶中加入药品的顺序是:先加入_____,再缓慢加入____,最后再加入几粒碎瓷片。
(3)加热圆底烧瓶,使温度迅速上升到________℃,观察到烧瓶中的无色液体逐渐变黑。该黑色的物质是_______。
(4)酸性KMnO4溶液很快褪色,但不能说明乙烯具有还原性。理由是:_______________。
(5)选用下列装置(可重复使用也可不用)来证明乙烯具有还原性,请将装置按编号依次排列,并在装置序号对应位置的下一行写出装置内所放的药品。

装置a→_____________________________→b。
药品:(a药品略)_________________________(b酸性KMnO4溶液)。
(6)若将b中酸性KMnO4溶液换成溴水,溴水也能褪色且可观察到b底部有少量无色油状液体生成,如何通过实验证明该无色油状液体中含有溴元素?______。如何通过实验证明乙烯和溴水发生的是加成反应而不是取代反应?____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在生产生活及科学研究方面应用非常广泛。回答下列问题:
(1)Fe原子的核外电子排布式为_____。
(2)含锰奥氏体钢是一种特殊的铁合金,主要由Fe和Mn组成,其中锰能增加钢铁的强度和硬度,提高耐冲击性能和耐磨性能。第一电离能I1(Fe)____(填“大于”或“小于”)I1(Mn),原因是___。
(3)FeF3具有较高的熔点(熔点高于1000℃),其化学键类型是__,FeBr3的式量大于FeF3,但其熔点只有200℃,原因是____。
(4)FeCl3可与KSCN、苯酚溶液发生显色反应。
①SCN-的三种元素中电负性最大的是____。
②苯酚(![]() )分子中氧原子的杂化形式为___。苯酚分子中的大π键可用符号πmn表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则m=____,n=___。
)分子中氧原子的杂化形式为___。苯酚分子中的大π键可用符号πmn表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则m=____,n=___。
(5)Fe(CO)3与NH3在一定条件下可合成一种具有磁性的氮化铁。该磁性氮化铁的晶胞结构如图所示。六棱柱底边边长为acm,高为ccm,阿伏加德罗常数的值为NA,该磁性氮化铁的密度为____(列出计算式)g·cm-3。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com