
【题目】根据能量变化示意图,下列说法正确的是( )

A. 状态1是液态,则状态3一定是气态
B. 状态3是液态,则状态4一定是气态
C. A(状态2)+B(g)═C(状态3)+D(g)△H=(d﹣a)kJmol﹣1
D. 断裂1molC(状态3)和1molD(g)中的化学键需要吸收的能量为(e﹣d)kJ
科目:高中化学 来源: 题型:
【题目】现代火法炼锌过程中发生了以下三个主要反应。下列说法正确的是
① 2ZnS(s) + 3O2(g)=2ZnO(s)+2SO2(g) △H1=a kJ mol-1
② 2C(s) +O2(g)=2CO(g) △H2=b kJ mol-1
③ ZnO(s) +CO(g)=Zn(g) +CO2(g) △H3=c kJ mol-1
A. 以上三个反应中,只有①是放热反应
B. 反应②的作用是仅为反应③提供还原剂
C. 用这种方法得到的是纯净的锌单质
D. 反应ZnS(s)+C(s)+2O2(g)=Zn(g)+SO2(g)+CO2(g)的△H=![]() kJ mol-1
kJ mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中提取镁,可按如下步骤进行:
①把贝壳制成石灰乳;
②在引入的海水中加入石灰乳,沉降、过滤、洗涤沉淀物;
③将沉淀物与盐酸反应,结晶过滤、在HCl气体氛围中干燥产物;
④将得到的产物熔融电解得到镁。
下列说法不正确的是( )
A. 此法的优点之一是原料来源丰富B. ①②③步骤的目的是从海水中提取镁盐
C. ①②③步骤涉及化合、分解和复分解反应D. 第①到第④步的反应都是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲配制100mL 1.0 mol/L Na2CO3溶液,正确的方法是
① 将10.6 g Na2CO3 溶于100mL水中
② 将28.6g Na2CO3·10H2O溶于水配成100 mL溶液
③ 将20 ml 5.0 mol/L Na2CO3溶液加水稀释至100 mL
A. ①②③ B. ②③ C. 只有② D. 只有③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应过程能量变化如图所示,下列说法正确的是

A. 反应过程a有催化剂参与
B. 该反应为吸热反应,热效应等于△H
C. 有催化剂的条件下,反应的活化能等于E1+E2
D. 改变催化剂,可改变该反应的活化能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将如图所示实验装置的K闭合,下列判断正确的是

A. Cu电极上发生还原反应
B. 电子沿Zn→a→b→Cu路径流动
C. 盐桥中K+向移向ZnSO4溶液
D. 片刻后可观察到滤纸b点变红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如右图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中。下列分析正确的()
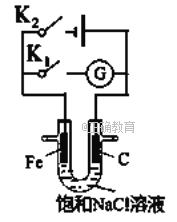
A. K1闭合,铁棒上发生的反应为2H++2e-=H2↑
B. K1闭合,石墨棒周围溶液碱性增强
C. K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法
D. K2闭合,电路中通过0.002NA个电子时,两极共产生0.001mol气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,稀盐酸和氨水按不同体积比混合得到四种溶液,各取20mL溶液,用0.1molL﹣1NaOH溶液滴定,溶液的pH随NaOH溶液的体积变化如图所示,下列说法正确的是( )

A. 滴至pH=7时,四种溶液中均存在c(Na+)=c(Cl﹣)
B. 原盐酸的浓度是0.1molL﹣1
C. V(NaOH)=10mL,溶液中Na+浓度a>b
D. 当V(NaOH)>20mL时,四种溶液的pH相同,溶液中的NH4+浓度近似相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KIO3是一种重要的无机化合物,可作为食盐中的补碘剂,常见制备方法如下。
(1)氯酸钾氧化法:化学反应方程式为:6I2+11KClO3+3H2O=6KH(IO3)2+5KC1+3C12,每生成3mol KH(IO3)2,反应中转移的电子数为______,向反应后溶液中加______溶液得到KIO3。
(2)一种由含碘废水制取碘酸钾的工艺如图:

①进行“过滤1”时,需同时对CuI沉淀进行洗涤。在洗涤液中可通过滴加______盐溶液来检验其是否已洗涤干净。
②“制FeI2”时,发生反应的化学方程式为______。
③在KIO3、KHSO3的酸性混合溶液中加入少量KI(催化剂)和淀粉,不停地搅拌,反应机理为:第一步IO3-+5I-+6H+=3I2+3H2O第二步反应的离子方程式为______。
当反应进行到1.5min时,溶液突然变为蓝色,随之又很快消失,则第______步反应速率快。
④改变反应温度,重复上述实验,得到温度(T)与溶液变蓝所需时间(t)的关系如图所示(超过50℃后溶液不会再变蓝)。根据图象,请你分析温度低于50℃时,溶液变蓝所需时间与反应温度的关系:_________。

(3)山东省已下调食用盐碘含量标准每千克盐含碘25毫克(波动范围为18~33mgkg-1)。测定食盐试样中碘元素含量的步骤如下:称取4.000g市售食盐加入锥形瓶中,依次加入适量的水、稍过量KI及稀硫酸;充分反应后,再加入12.00mL6.000×10-4molL-1Na2S2O3溶液,与生成的碘恰好完全反应。有关反应原理为:
KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O;I2+2S2O32-=2I-+S4O62-。计算该食盐试样中碘元素的含量______mgkg-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com