
【题目】在25℃、101 kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ,下列热化学方程式书写正确的是()
A. CH3OH(l)+3/2O2(g)![]() CO2(g)+2H2O(l) ΔH=+725.76 kJ·mol-1
CO2(g)+2H2O(l) ΔH=+725.76 kJ·mol-1
B. 2CH3OH(l)+3O2(g)![]() 2CO2(g)+4H2O(l) ΔH=-1 451.52 kJ·mol-1
2CO2(g)+4H2O(l) ΔH=-1 451.52 kJ·mol-1
C. 2CH3OH(l)+3O2(g)![]() 2CO2(g)+4H2O(l) ΔH=-725.76 kJ·mol-1
2CO2(g)+4H2O(l) ΔH=-725.76 kJ·mol-1
D. 2CH3OH(l)+3O2(g)![]() 2CO2(g)+4H2O(l)ΔH=+1451.52 kJ·mol-1
2CO2(g)+4H2O(l)ΔH=+1451.52 kJ·mol-1
【答案】B
【解析】
1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ,则64g即2mol甲醇燃烧放的热量为1451.52 kJ
A、甲醇燃烧是放热反应,焓变值为负值,故A错误;
B、1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ,则64g即2mol甲醇燃烧放的热量为1451.52 kJ,热化学方程式为:2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=-1451.52 kJ·mol-1,故B正确;
C、1g甲醇燃烧生成CO2和液态水时放热22.68 kJ,则64g即2mol甲醇燃烧放的热量为1451.52 kJ,反应热数值计算错误,故C错误;
D、甲醇燃烧是放热反应,焓变值为负值,故D错误。
综上所述,本题正确答案为B。


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案科目:高中化学 来源: 题型:
【题目】某反应过程能量变化如图所示,下列说法正确的是

A. 反应过程a有催化剂参与
B. 该反应为吸热反应,热效应等于△H
C. 有催化剂的条件下,反应的活化能等于E1+E2
D. 改变催化剂,可改变该反应的活化能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(加试题)烟气(主要污染物SO2、NO、NO2)的大量排放造成严重的大气污染,国内较新研究成果是采用以尿素为还原剂的脱硫脱硝一体化技术。
(1)脱硫总反应:SO2(g)+CO(NH2)2(aq)+2H2O(l)+1/2O2(g)=(NH2)SO4(aq)+CO2(g),已知该反应能自发进行,则条件是____(填“高温”、“低温”或“任何温度”)。
(2)电解稀硫酸制备O3(原理如图),则产生O3的电极反应式为______。


(3)室温下,往恒容的反应器中加入固定物质的量的SO2和NO,通入O3充分混合。反应相同时间后,各组分的物质的量随n(O3)∶n(NO)的变化见上图。
① n(NO2)随n(O3)∶n(NO)的变化先增加后减少,原因是____。
② 臭氧量对反应SO2(g)+O3(g)=SO3(g)+O2(g)的影响不大,试用过渡态理论解释可能原因__。
(4)通过控制变量法研究脱除效率的影响因素得到数据如下图所示,下列说法正确的是____。
A. 烟气在尿素溶液中的反应:v(脱硫)<v(脱硝)
B. 尿素溶液pH的变化对脱硝效率的影响大于对脱硫效率的影响
C. 强酸性条件下不利于尿素对氮氧化物的脱除
D. pH=7的尿素溶液脱硫效果最佳


(5)尿素的制备:2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g) ΔH<0。一定条件下,往10 L恒容密闭容器中充入2 mol NH3和1 mol CO2。
CO(NH2)2(s)+H2O(g) ΔH<0。一定条件下,往10 L恒容密闭容器中充入2 mol NH3和1 mol CO2。
① 该反应10 min 后达到平衡,测得容器中气体密度为4.8 g·L-1,平衡常数K=__。

② 上图是该条件下,系统中尿素的物质的量随反应时间的变化趋势,当反应时间达到3min 时,迅速将体系升温,请在图中画出3~10 min 内容器中尿素的物质的量的变化趋势曲线__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁氮化合物(FexNy)在磁记录材料领域有着广泛的应用前景。某FexNy的制备需铁、氮气、丙酮和乙醇参与。
(1)Fe基态原子结构示意图__________。
(2)丙酮( )分子中各元素电负性从大到小顺序是________,1 mol丙酮分子中含有σ键的数目为________。
)分子中各元素电负性从大到小顺序是________,1 mol丙酮分子中含有σ键的数目为________。
(3)某FexNy的晶胞如图1所示,Cu可以完全替代该晶体中a位置Fe或者b位置Fe,形成Cu替代型产物Fe(x-n)CunNy。FexNy转化为两种Cu替代型产物的能量变化如图2所示,其中更稳定的Cu替代型产物的化学式为________。


(4)科学家制得由20个碳原子组成的 空心笼状分子C20,该笼状结构是由许多正五边形构成(如图)。

请回答:一个 C20分子共有_______条棱边,推测C20晶体的硬度_______(填较大或较小)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲醛在浓氢氧化钾溶液中发生Cannizzaro反应,反应方程式如下,可用于制备苯甲酸和苯甲醇。
2![]() +KOH
+KOH![]()
![]() \
\
![]() +HCl
+HCl![]()
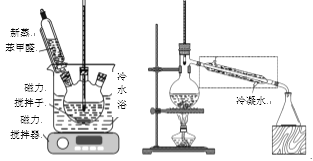
已知:
①乙醚微溶于水,是有机物良好的溶剂,沸点34.6℃,极易挥发,在空气中的沸点160℃。
②苯甲酸在水中的溶解度0.17g(25℃),0.95g(50℃),6.8g(95℃)
实验步骤:
①在50mL三口瓶中加入4.5g KOH和4.5mL水,将装置置于冷水浴中,打开磁力搅拌器,分批加入5mL 新蒸苯甲醛(密度1.04g/mL),使反应物充分混合(如上左图),最后成为白色糊状物,放置24h以上。
②向反应混合物中逐渐加入足量水并震荡,使其完全溶解后倒入_____(填装置名称)中,用10mL 乙醚萃取3次,合并乙醚萃取液,并依次用3mL饱和亚硫酸氢钠、5mL 10% Na2CO3溶液及5mL水洗涤,分出的乙醚层用无水Na2CO3干燥。
③干燥后的乙醚溶液在水浴中蒸去乙醚,然后适当调整和改造装置(如上右图),继续加热蒸馏,收集198℃~204℃的苯甲醇馏分,产量为2.16g。
④乙醚萃取后的水溶液(水层),用浓盐酸酸化并充分冷却,使苯甲酸完全析出,过滤,粗产品用水重结晶得到苯甲酸,产量是2g。
(1)不断搅拌然后放置24h的目的是____________________________________
(2)步骤②横线处装置名称是___________________________
(3)萃取液共洗涤了3次,其中10% 碳酸钠溶液欲除去的杂质是_______(填化学式)

(4)使用水浴蒸去乙醚的优点是_____________
(5)蒸去乙醚后适当的调整和改造装置,应将上右图虚线框中的装置换为________。
(6)苯甲酸重结晶时,常用冷水洗涤固体,其目的是______;苯甲酸重结晶时所需的玻璃仪器有__________________
①烧杯 ②试管 ③锥形瓶 ④酒精灯 ⑤量筒 ⑥短颈玻璃漏斗 ⑦玻璃棒
(7)该实验中Cannizzaro反应的转化率是_____%(保留1位小数)。通常,该实验中苯甲酸的产率会比苯甲醇更低,但若是某次实验中并未塞紧瓶塞,导致苯甲酸的产率明显偏高,分析可能的原因是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KIO3是一种重要的无机化合物,可作为食盐中的补碘剂,常见制备方法如下。
(1)氯酸钾氧化法:化学反应方程式为:6I2+11KClO3+3H2O=6KH(IO3)2+5KC1+3C12,每生成3mol KH(IO3)2,反应中转移的电子数为______,向反应后溶液中加______溶液得到KIO3。
(2)一种由含碘废水制取碘酸钾的工艺如图:

①进行“过滤1”时,需同时对CuI沉淀进行洗涤。在洗涤液中可通过滴加______盐溶液来检验其是否已洗涤干净。
②“制FeI2”时,发生反应的化学方程式为______。
③在KIO3、KHSO3的酸性混合溶液中加入少量KI(催化剂)和淀粉,不停地搅拌,反应机理为:第一步IO3-+5I-+6H+=3I2+3H2O第二步反应的离子方程式为______。
当反应进行到1.5min时,溶液突然变为蓝色,随之又很快消失,则第______步反应速率快。
④改变反应温度,重复上述实验,得到温度(T)与溶液变蓝所需时间(t)的关系如图所示(超过50℃后溶液不会再变蓝)。根据图象,请你分析温度低于50℃时,溶液变蓝所需时间与反应温度的关系:_________。

(3)山东省已下调食用盐碘含量标准每千克盐含碘25毫克(波动范围为18~33mgkg-1)。测定食盐试样中碘元素含量的步骤如下:称取4.000g市售食盐加入锥形瓶中,依次加入适量的水、稍过量KI及稀硫酸;充分反应后,再加入12.00mL6.000×10-4molL-1Na2S2O3溶液,与生成的碘恰好完全反应。有关反应原理为:
KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O;I2+2S2O32-=2I-+S4O62-。计算该食盐试样中碘元素的含量______mgkg-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中的一定量混合气体发生反应:x A(g) + y B(g) ![]() z C(g),平衡时测得A的浓度为0.5 mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再次达到平衡时,测得A的浓度降低为0.3 mol/L,下列有关判断正确的是( )
z C(g),平衡时测得A的浓度为0.5 mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再次达到平衡时,测得A的浓度降低为0.3 mol/L,下列有关判断正确的是( )
A.x + y < z B.B的转化率降低
C.平衡向正反应方向移动 D.C的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前碘酸钾被广泛应用于食盐加碘。一种由含碘废水制取碘酸钾的工艺如下:
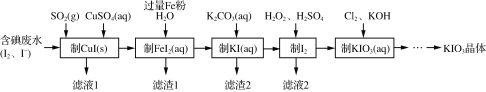
(1)检验“含碘废水”中是否含有单质I2,常用的试剂是________。
(2)通入SO2的目的是将I2还原为I-,该反应的离子方程式为__________________________________。
(3)滤渣1的成分为________。

(4)“制KI(aq)”时,Fe2+会水解形成胶状物吸附KI,造成I-的损失。已知此温度下,Kw=1.0×10-13,Ksp[Fe(OH)2]=9.0×10-15。现测得溶液中c(FeI2)为0.9 mol·L-1,为减少I-的损失,起始时,加入K2CO3必须保持FeI2溶液的pH不大于________。
(5)“制KIO3溶液”时,发生反应的离子方程式为_______________________________。
(6) KCl、KIO3的溶解度曲线如图所示。由KIO3溶液得到KIO3晶体的方法为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LiH2PO4是制备电池的重要原料。室温下,LiH2PO4溶液的pH随c初始(H2PO4–)的变化如图1所示,H3PO4溶液中H2PO4–的分布分数δ随pH的变化如图2所示,[![]() ]下列有关LiH2PO4溶液的叙述正确的是
]下列有关LiH2PO4溶液的叙述正确的是


A. 溶液中存在3个平衡
B. 含P元素的粒子有H2PO4–、HPO42–、PO43–
C. 随c初始(H2PO4–)增大,溶液的pH明显变小
D. 用浓度大于1 mol·L-1的H3PO4溶液溶解Li2CO3,当pH达到4.66时,H3PO4几乎全部转化为LiH2PO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com