
【题目】铁氮化合物(FexNy)在磁记录材料领域有着广泛的应用前景。某FexNy的制备需铁、氮气、丙酮和乙醇参与。
(1)Fe基态原子结构示意图__________。
(2)丙酮( )分子中各元素电负性从大到小顺序是________,1 mol丙酮分子中含有σ键的数目为________。
)分子中各元素电负性从大到小顺序是________,1 mol丙酮分子中含有σ键的数目为________。
(3)某FexNy的晶胞如图1所示,Cu可以完全替代该晶体中a位置Fe或者b位置Fe,形成Cu替代型产物Fe(x-n)CunNy。FexNy转化为两种Cu替代型产物的能量变化如图2所示,其中更稳定的Cu替代型产物的化学式为________。


(4)科学家制得由20个碳原子组成的 空心笼状分子C20,该笼状结构是由许多正五边形构成(如图)。

请回答:一个 C20分子共有_______条棱边,推测C20晶体的硬度_______(填较大或较小)
【答案】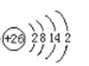 O>C>H 9 NA Fe3CuN 30 较小
O>C>H 9 NA Fe3CuN 30 较小
【解析】
(1)铁为26号元素,根据核外电子排布规律画出原子结构示意图;
(2)非金属性越强电负性越大;![]() 中单键均为σ键,双键中含1个σ键,甲基上C形成4个σ键,C=O中C形成3个σ键;
中单键均为σ键,双键中含1个σ键,甲基上C形成4个σ键,C=O中C形成3个σ键;
(3)由图2可知,Cu替代a位置的Fe时能量较低,更稳定,则Cu位于顶点,N(Cu)=8×![]() =1,Fe位于面心,N(Fe)=6×
=1,Fe位于面心,N(Fe)=6×![]() =3,N位于体心;
=3,N位于体心;
(4)利用均摊法分析晶体结构,每个碳原子与另外3个碳原子成键,2个原子形成一个键,以此来解答。
(1)Fe的原子序数为26,原子结构示意图为: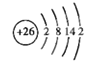 ,
,
故答案为: ;
;
(2)非金属性越强,电负性越大,则C、H、O三种元素的电负性由大到小的顺序为O>C>H;![]() 中单键均为σ键,双键中含1个σ键,甲基上C形成4个σ键,C=O中C形成3个σ键,1mol丙酮共有9molσ键,数目为9NA个,
中单键均为σ键,双键中含1个σ键,甲基上C形成4个σ键,C=O中C形成3个σ键,1mol丙酮共有9molσ键,数目为9NA个,
故答案为:O>C>H;9NA;
(3)由图2可知,Cu替代a位置的Fe时能量较低,更稳定,则Cu位于顶点,N(Cu)=8×![]() =1,Fe位于面心,N(Fe)=6×
=1,Fe位于面心,N(Fe)=6×![]() =3,N位于体心,则只有1个N,其化学式为Fe3CuN,
=3,N位于体心,则只有1个N,其化学式为Fe3CuN,
故答案为:Fe3CuN;
(4)从分子结构示意图可以看出,在C20分子内每个碳原子与另外3个碳原子成键,因此,C20分子键总数=20×3×![]() (因为2个原子形成一个键),也即C20分子中共有30条棱边(因为化学键总数=多面体棱边总数)。
(因为2个原子形成一个键),也即C20分子中共有30条棱边(因为化学键总数=多面体棱边总数)。
C20与C60都属于碳的同素异形体,应属于分子晶体,所以推测C20晶体的硬度较小;
故答案为:30;较小。


科目:高中化学 来源: 题型:
【题目】有 X、Y、Z 三种元素:①X、Y、Z 的单质在常温下均为气体,②X 单质可以在 Z 的单质中燃烧,生 成化合物 XZ,火焰呈苍白色,③XZ 极易溶于水,在水溶液中电离处 X+和 Z﹣,其水溶液能使蓝色石蕊试 纸变红,④每两个 X2 分子能与一个 Y2分子化合成两个 X2Y 分子,X2Y 常温下为液体,⑤Z 单质溶于 X2Y 中,所得的溶液具有漂白性。
(1)写出下列微粒的电子式:X+_____,Z﹣______,Y 原子_____。
(2)写出 X2Y 的化学式_____。按要求与 X2Y 分子具有相同电子数的微粒的化学符号:两个原子核 的阴离子_____,5 个原子核的分子_____。
(3)写出 Z 单质溶于 X2Y 中发生反应的离子方程式:_____,所得溶液能使淀粉碘 化钾溶液变蓝,主要起作用的微粒是_____。
(4)实验室制备 XZ 的化学方程式:_____,如何检验 XZ 是否收集满__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据能量变化示意图,下列说法正确的是( )

A. 状态1是液态,则状态3一定是气态
B. 状态3是液态,则状态4一定是气态
C. A(状态2)+B(g)═C(状态3)+D(g)△H=(d﹣a)kJmol﹣1
D. 断裂1molC(状态3)和1molD(g)中的化学键需要吸收的能量为(e﹣d)kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是氯化铯晶体的晶胞(晶体中的最小重复单元),已知晶体中两个最近的Cs+离子核间距离为a cm,氯化铯的相对分子质量为M,NA为阿伏加德罗常数,则氯化铯晶体密度是( )

A. ![]() g/cm3 B.
g/cm3 B. ![]() g/cm3 C.
g/cm3 C. ![]() g/cm3 D.
g/cm3 D. ![]() g/cm3
g/cm3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1807年化学家戴维电解熔融氢氧化钠制得钠:4NaOH(熔融)![]() O2↑+4Na+2H2O;后来盖·吕萨克用铁与熔融氢氧化钠作用也制得钠:3Fe+4NaOH=Fe3O4+2H2↑+4Na↑。下列有关说法正确的是
O2↑+4Na+2H2O;后来盖·吕萨克用铁与熔融氢氧化钠作用也制得钠:3Fe+4NaOH=Fe3O4+2H2↑+4Na↑。下列有关说法正确的是
A. 戴维法制钠,阳极的电极反应式为:Na++e-=Na↑
B. 盖·吕萨克法制钠原理是利用铁的金属性比钠的强
C. 若用戴维法与盖·吕萨克法制得等量的钠,两方法转移电子总数相等
D. 还可以用电解熔融氯化钠法制钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化碳的有效回收利用,既能缓解能源危机,又可减少温室效应的影响,具有解决能源问题及环保问题的双重意义。Zn/ZnO热化学循环还原CO2制CO的原理如下图所示,回答下列问题:

(1)①从循环结果看,能量转化的主要方式是______________ ;
②反应2CO2(g)=2CO(g)+O2(g) △H=_________kJ/mol。
③Zn/ZnO在反应中循环使用,其作用是__________________
(2)二甲醚是主要的有机物中间体,在一定条件下利用CO2与H2可直接合成二甲醚:2CO2(g) +6H2(g)![]() CH3OCH3(g)+3H2O(g) ,
CH3OCH3(g)+3H2O(g) ,![]() =3时,实验测得CO2的平衡转化率随温度及压强变化如下图所示。
=3时,实验测得CO2的平衡转化率随温度及压强变化如下图所示。
①该反应的△H =______0(填“>”或“<”)。
②图中压强(P)由大到小的顺序是__________________。
③若在1L密闭容器中充入0.2molCO2和0.6molH2,CO2的平衡转化率对应下图中A点,则在此温度,该反应的化学平衡常数是___________(保留整数)。
④合成二甲醚过程中往往会生成一氧化碳,合成时选用硅铝化合物做催化剂,硅铝比不同时,生成二甲醚或一氧化碳的物质的量分数不同。硅铝比与产物选择性如下图所示。图中A点和B点的化学平衡常数比较:KA____KB(填“>、<、=”)。根据以上两条曲线,写出其中一条变化规律:_______________________。

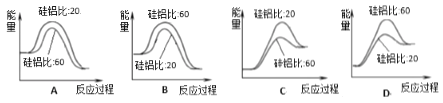
⑤上图是使用不同硅铝比化合物做催化剂制备二甲醚的能量变化示意图,其中正确且最佳的是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃、101 kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ,下列热化学方程式书写正确的是()
A. CH3OH(l)+3/2O2(g)![]() CO2(g)+2H2O(l) ΔH=+725.76 kJ·mol-1
CO2(g)+2H2O(l) ΔH=+725.76 kJ·mol-1
B. 2CH3OH(l)+3O2(g)![]() 2CO2(g)+4H2O(l) ΔH=-1 451.52 kJ·mol-1
2CO2(g)+4H2O(l) ΔH=-1 451.52 kJ·mol-1
C. 2CH3OH(l)+3O2(g)![]() 2CO2(g)+4H2O(l) ΔH=-725.76 kJ·mol-1
2CO2(g)+4H2O(l) ΔH=-725.76 kJ·mol-1
D. 2CH3OH(l)+3O2(g)![]() 2CO2(g)+4H2O(l)ΔH=+1451.52 kJ·mol-1
2CO2(g)+4H2O(l)ΔH=+1451.52 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示:

(1)①该反应是__________反应(填“吸热”或“放热”)。
②当反应达到平衡时,升高温度,A的转化率__________(填“增大”“减小”“不变”)。
③在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1__________,E2__________(填“增大”“减小”“不变”)。
(2)101 kPa时,1 mol H2完全燃烧生成液态水,放出285.8 kJ的热量,表示H2燃烧热的化学方程式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,等质量的CO和CO2相比,下列叙述中正确的是
A.所含碳原子数比为1:1 B.体积比为7:11
C.密度比为7:11 D.分子数比为7:11
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com