
【题目】如图是氯化铯晶体的晶胞(晶体中的最小重复单元),已知晶体中两个最近的Cs+离子核间距离为a cm,氯化铯的相对分子质量为M,NA为阿伏加德罗常数,则氯化铯晶体密度是( )

A. ![]() g/cm3 B.
g/cm3 B. ![]() g/cm3 C.
g/cm3 C. ![]() g/cm3 D.
g/cm3 D. ![]() g/cm3
g/cm3
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:
【题目】从海水中提取镁,可按如下步骤进行:
①把贝壳制成石灰乳;
②在引入的海水中加入石灰乳,沉降、过滤、洗涤沉淀物;
③将沉淀物与盐酸反应,结晶过滤、在HCl气体氛围中干燥产物;
④将得到的产物熔融电解得到镁。
下列说法不正确的是( )
A. 此法的优点之一是原料来源丰富B. ①②③步骤的目的是从海水中提取镁盐
C. ①②③步骤涉及化合、分解和复分解反应D. 第①到第④步的反应都是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如右图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中。下列分析正确的()
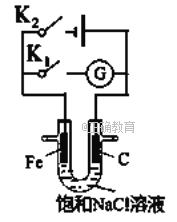
A. K1闭合,铁棒上发生的反应为2H++2e-=H2↑
B. K1闭合,石墨棒周围溶液碱性增强
C. K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法
D. K2闭合,电路中通过0.002NA个电子时,两极共产生0.001mol气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,稀盐酸和氨水按不同体积比混合得到四种溶液,各取20mL溶液,用0.1molL﹣1NaOH溶液滴定,溶液的pH随NaOH溶液的体积变化如图所示,下列说法正确的是( )

A. 滴至pH=7时,四种溶液中均存在c(Na+)=c(Cl﹣)
B. 原盐酸的浓度是0.1molL﹣1
C. V(NaOH)=10mL,溶液中Na+浓度a>b
D. 当V(NaOH)>20mL时,四种溶液的pH相同,溶液中的NH4+浓度近似相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(加试题)烟气(主要污染物SO2、NO、NO2)的大量排放造成严重的大气污染,国内较新研究成果是采用以尿素为还原剂的脱硫脱硝一体化技术。
(1)脱硫总反应:SO2(g)+CO(NH2)2(aq)+2H2O(l)+1/2O2(g)=(NH2)SO4(aq)+CO2(g),已知该反应能自发进行,则条件是____(填“高温”、“低温”或“任何温度”)。
(2)电解稀硫酸制备O3(原理如图),则产生O3的电极反应式为______。


(3)室温下,往恒容的反应器中加入固定物质的量的SO2和NO,通入O3充分混合。反应相同时间后,各组分的物质的量随n(O3)∶n(NO)的变化见上图。
① n(NO2)随n(O3)∶n(NO)的变化先增加后减少,原因是____。
② 臭氧量对反应SO2(g)+O3(g)=SO3(g)+O2(g)的影响不大,试用过渡态理论解释可能原因__。
(4)通过控制变量法研究脱除效率的影响因素得到数据如下图所示,下列说法正确的是____。
A. 烟气在尿素溶液中的反应:v(脱硫)<v(脱硝)
B. 尿素溶液pH的变化对脱硝效率的影响大于对脱硫效率的影响
C. 强酸性条件下不利于尿素对氮氧化物的脱除
D. pH=7的尿素溶液脱硫效果最佳


(5)尿素的制备:2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g) ΔH<0。一定条件下,往10 L恒容密闭容器中充入2 mol NH3和1 mol CO2。
CO(NH2)2(s)+H2O(g) ΔH<0。一定条件下,往10 L恒容密闭容器中充入2 mol NH3和1 mol CO2。
① 该反应10 min 后达到平衡,测得容器中气体密度为4.8 g·L-1,平衡常数K=__。

② 上图是该条件下,系统中尿素的物质的量随反应时间的变化趋势,当反应时间达到3min 时,迅速将体系升温,请在图中画出3~10 min 内容器中尿素的物质的量的变化趋势曲线__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是典型晶体的结构示意图,从①到⑥对应正确的是:
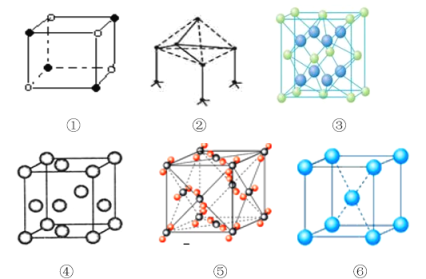
选项 | ① | ② | ③ | ④ | ⑤ | ⑥ |
A | NaCl | 单质硅 | CaF2 | Au | CO2 | K |
B | CaF2 | SiC | 金刚石 | Cu | CO2 | CsCl |
C | CsCl | 金刚石 | CaF2 | Cu | CO2 | Mg |
D | NaCl | BN | Au | CaF2 | CO2 | Na |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁氮化合物(FexNy)在磁记录材料领域有着广泛的应用前景。某FexNy的制备需铁、氮气、丙酮和乙醇参与。
(1)Fe基态原子结构示意图__________。
(2)丙酮( )分子中各元素电负性从大到小顺序是________,1 mol丙酮分子中含有σ键的数目为________。
)分子中各元素电负性从大到小顺序是________,1 mol丙酮分子中含有σ键的数目为________。
(3)某FexNy的晶胞如图1所示,Cu可以完全替代该晶体中a位置Fe或者b位置Fe,形成Cu替代型产物Fe(x-n)CunNy。FexNy转化为两种Cu替代型产物的能量变化如图2所示,其中更稳定的Cu替代型产物的化学式为________。


(4)科学家制得由20个碳原子组成的 空心笼状分子C20,该笼状结构是由许多正五边形构成(如图)。

请回答:一个 C20分子共有_______条棱边,推测C20晶体的硬度_______(填较大或较小)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KIO3是一种重要的无机化合物,可作为食盐中的补碘剂,常见制备方法如下。
(1)氯酸钾氧化法:化学反应方程式为:6I2+11KClO3+3H2O=6KH(IO3)2+5KC1+3C12,每生成3mol KH(IO3)2,反应中转移的电子数为______,向反应后溶液中加______溶液得到KIO3。
(2)一种由含碘废水制取碘酸钾的工艺如图:

①进行“过滤1”时,需同时对CuI沉淀进行洗涤。在洗涤液中可通过滴加______盐溶液来检验其是否已洗涤干净。
②“制FeI2”时,发生反应的化学方程式为______。
③在KIO3、KHSO3的酸性混合溶液中加入少量KI(催化剂)和淀粉,不停地搅拌,反应机理为:第一步IO3-+5I-+6H+=3I2+3H2O第二步反应的离子方程式为______。
当反应进行到1.5min时,溶液突然变为蓝色,随之又很快消失,则第______步反应速率快。
④改变反应温度,重复上述实验,得到温度(T)与溶液变蓝所需时间(t)的关系如图所示(超过50℃后溶液不会再变蓝)。根据图象,请你分析温度低于50℃时,溶液变蓝所需时间与反应温度的关系:_________。

(3)山东省已下调食用盐碘含量标准每千克盐含碘25毫克(波动范围为18~33mgkg-1)。测定食盐试样中碘元素含量的步骤如下:称取4.000g市售食盐加入锥形瓶中,依次加入适量的水、稍过量KI及稀硫酸;充分反应后,再加入12.00mL6.000×10-4molL-1Na2S2O3溶液,与生成的碘恰好完全反应。有关反应原理为:
KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O;I2+2S2O32-=2I-+S4O62-。计算该食盐试样中碘元素的含量______mgkg-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸和一水合氨是中学化学中常见的弱电解质。
(1)常温下,某研究性学习小组设计了如下方案证明醋酸为弱电解质,你认为方案可行的是_______(填序号)
①配制一定量的0.10 mol/L CH3COOH溶液,然后测溶液的pH,若pH大于1,则证明醋酸为弱电解质。
②用醋酸溶液和盐酸做导电性实验,若醋酸溶液导电性弱,则证明醋酸为弱电解质。
③将pH=2的CH3COOH溶液加水稀释100倍后,若pH>4,则证明醋酸为弱电解质。
④配制一定量的CH3COONa溶液,测其pH,若pH大于7,则证明醋酸为弱电解质。
(2)若25℃时,0.10 mol/L的CH3COOH的电离度为1%,则该溶液的pH=________,由醋酸电离出的c(H+)约为水电离出的c(H+)的_________倍。
(3)已知在25℃时,醋酸的电离平衡常数为Ka=1.8×10-5。常温下,0.1mol/LNaOH溶液V1 mL和0.2mol/LCH3COOH溶液V2 mL混合后(忽略混合前后溶液体积的变化)溶液的pH=7。
①反应后溶液中离子浓度的大小关系为_________________________________________________。
②V1:V2 __________(填“>”、“<”或“=”)2:1
③c(CH3COO-):c(CH3COOH)=__________________。
(4)常温下,可用氨水吸收废气中的CO2得到NH4HCO3溶液,在该溶液中,c(NH4+)_______(填“>”、“<”或“=”)c(HCO3-);反应NH4++HCO3-+H2O![]() NH3·H2O+H2CO3的平衡常数K=_________。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数Ka1=4×10-7,Ka2=4×10-11)
NH3·H2O+H2CO3的平衡常数K=_________。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数Ka1=4×10-7,Ka2=4×10-11)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com