
【题目】聚乳酸E在服装、卫生医疗制品等行业具有广泛的应用。某有机化合物A在一定条件下通过一系列反应可合成E;同时还可得到C和D等重要有机化合物。转化关系如下图:

完成下列填空:
(1)B→E反应类型:_____________, D→G实验室中反应条件:________________。
(2)A的分子式:___________________。
(3)与F同类别的同分异构体还有HCOOCH(CH3)2 、HCOOCH2CH2CH3和______________(用结构简式表示)。
(4)写出实验室中判断D中有G生成的方法___________________________________________________ (5)石油产品丙烯及必要的无机试剂可合成丙烯酸,设计合成路线如下:CH3CH=CH2![]() ClCH2CH=CH2→甲→乙→丙
ClCH2CH=CH2→甲→乙→丙![]() 丙烯酸
丙烯酸
已知:
i.![]()
请完成合成路线中的:ClCH2CH=CH2→甲→乙→丙____________。
【答案】聚合反应 Cu(或Ag)/△ C7H12O3 CH3CH2COOCH3 取样,加入少量新制的氢氧化铜浊液,加热煮沸,有砖红色沉淀生成 ClCH2CH=CH2![]() HOCH2CH=CH2
HOCH2CH=CH2![]() HOCH2CHBrCH2Br
HOCH2CHBrCH2Br![]() BrCH2CHBrCOOH
BrCH2CHBrCOOH
【解析】
由E的结构逆推可知B为CH3CH(OH)COOH,C与D在浓硫酸、加热条件下生成分子式为C4H8O2的F,应是发生酯化反应,而D可以转化生成分子式为C2H4O的G,可推知C为CH3COOH、D为CH3CH2OH、F为CH3COOCH2CH3、G为CH3CHO,故A的结构简式为:CH3COOCH(CH3)COOCH2CH3。
(5)由于碳碳双键易被氧化,应先氧化引入羧基,再引入碳碳双键。由信息可知,由BrCH2CHBrCOOH与Zn/乙醇作用得到丙烯酸,ClCH2CH=CH2先在碱性条件下水解,然后与溴发生加成反应,再用酸性高锰酸钾溶液氧化得到BrCH2CHBrCOOH。
(1)B→E是CH3CHOHCOOH发生缩聚反应生成高聚物,D→G是乙醇发生催化氧化生成乙醛,实验室中反应条件:Cu(或Ag)/△;
(2)A的结构简式为:CH3COOCH(CH3)COOCH2CH3,故A的分子式:C7H12O3;
(3)与F同类别的同分异构体还有HCOOCH(CH3)2、HCOOCH2CH2CH3和CH3CH2COOCH3,
故还有CH3CH2COOCH3;
(4)实验室中判断乙醇中有乙醛生成,通过检验醛基即可,实验方法为:取样,加入少量新制的氢氧化铜浊液,加热煮沸,有砖红色沉淀生成;
(5)由于碳碳双键易被氧化,应先氧化引入羧基,再引入碳碳双键。由信息可知,由BrCH2CHBrCOOH与Zn/乙醇作用得到丙烯酸,ClCH2CH=CH2先在碱性条件下水解,然后与溴发生加成反应,再用酸性高锰酸钾溶液氧化得到BrCH2CHBrCOOH.合成路线流程图为:ClCH2CH=CH2![]() HOCH2CH=CH2
HOCH2CH=CH2![]() HOCH2CHBrCH2Br
HOCH2CHBrCH2Br![]() BrCH2CHBrCOOH。
BrCH2CHBrCOOH。


科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式是( )
A. 向水中通入氯气:Cl2+H2O2H++Cl﹣+ClO﹣
B. 二氧化锰与浓盐酸反应:MnO2+4HCl(浓)![]() Mn2++2Cl2↑+2H2O
Mn2++2Cl2↑+2H2O
C. 碳酸氢钠溶液加过量澄清石灰水:2HCO3﹣+Ca2++2OH﹣═CaCO3↓+2H2O+CO32﹣
D. 金属钠与硫酸铜溶液反应:2Na+2H2O+Cu2+═2Na++Cu(OH)2↓+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲醛在浓氢氧化钾溶液中发生Cannizzaro反应,反应方程式如下,可用于制备苯甲酸和苯甲醇。
2![]() +KOH
+KOH![]()
![]() \
\
![]() +HCl
+HCl![]()
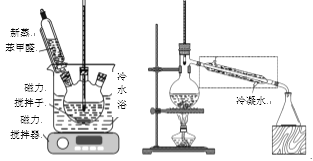
已知:
①乙醚微溶于水,是有机物良好的溶剂,沸点34.6℃,极易挥发,在空气中的沸点160℃。
②苯甲酸在水中的溶解度0.17g(25℃),0.95g(50℃),6.8g(95℃)
实验步骤:
①在50mL三口瓶中加入4.5g KOH和4.5mL水,将装置置于冷水浴中,打开磁力搅拌器,分批加入5mL 新蒸苯甲醛(密度1.04g/mL),使反应物充分混合(如上左图),最后成为白色糊状物,放置24h以上。
②向反应混合物中逐渐加入足量水并震荡,使其完全溶解后倒入_____(填装置名称)中,用10mL 乙醚萃取3次,合并乙醚萃取液,并依次用3mL饱和亚硫酸氢钠、5mL 10% Na2CO3溶液及5mL水洗涤,分出的乙醚层用无水Na2CO3干燥。
③干燥后的乙醚溶液在水浴中蒸去乙醚,然后适当调整和改造装置(如上右图),继续加热蒸馏,收集198℃~204℃的苯甲醇馏分,产量为2.16g。
④乙醚萃取后的水溶液(水层),用浓盐酸酸化并充分冷却,使苯甲酸完全析出,过滤,粗产品用水重结晶得到苯甲酸,产量是2g。
(1)不断搅拌然后放置24h的目的是____________________________________
(2)步骤②横线处装置名称是___________________________
(3)萃取液共洗涤了3次,其中10% 碳酸钠溶液欲除去的杂质是_______(填化学式)

(4)使用水浴蒸去乙醚的优点是_____________
(5)蒸去乙醚后适当的调整和改造装置,应将上右图虚线框中的装置换为________。
(6)苯甲酸重结晶时,常用冷水洗涤固体,其目的是______;苯甲酸重结晶时所需的玻璃仪器有__________________
①烧杯 ②试管 ③锥形瓶 ④酒精灯 ⑤量筒 ⑥短颈玻璃漏斗 ⑦玻璃棒
(7)该实验中Cannizzaro反应的转化率是_____%(保留1位小数)。通常,该实验中苯甲酸的产率会比苯甲醇更低,但若是某次实验中并未塞紧瓶塞,导致苯甲酸的产率明显偏高,分析可能的原因是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中的一定量混合气体发生反应:x A(g) + y B(g) ![]() z C(g),平衡时测得A的浓度为0.5 mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再次达到平衡时,测得A的浓度降低为0.3 mol/L,下列有关判断正确的是( )
z C(g),平衡时测得A的浓度为0.5 mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再次达到平衡时,测得A的浓度降低为0.3 mol/L,下列有关判断正确的是( )
A.x + y < z B.B的转化率降低
C.平衡向正反应方向移动 D.C的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合氯化铝晶体([Al2(OH)nCl(6-n)XH2O]m)是一种高效无机水处理剂。它的制备原理是调节AlCl3溶液的pH,通过促进其水解而结晶析出。
回答下列问题:
(1)铝原子核外能量最高的电子有_____个。分析AlCl3熔点较低的原因(熔点:AlCl3—194℃,Al2O3—2054℃,NaCl—801℃)。____________________________________________________
(2)比较聚合氯化铝晶体中同周期两种元素的原子半径,并用原子结构知识说明理由。___________
(3)铝灰(主要成分为Al、Al2O3,另有少量CuO、SiO2、FeO和Fe2O3杂质)可制备AlCl3,如果先除去铝灰中的金属氧化物杂质可选用__________(选填:“强碱”或“强酸”)。写出其中Al发生反应的离子方程式_______________________________。
(4)制备聚合氯化铝晶体,需严格控制溶液的pH在4.0~4.5才能使产率达到最大。结合AlCl3水解的离子方程式,用化学平衡移动原理解释控制pH在4.0~4.5之间的原因_______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前碘酸钾被广泛应用于食盐加碘。一种由含碘废水制取碘酸钾的工艺如下:
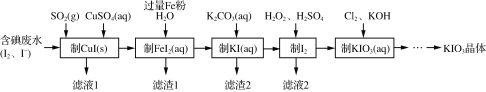
(1)检验“含碘废水”中是否含有单质I2,常用的试剂是________。
(2)通入SO2的目的是将I2还原为I-,该反应的离子方程式为__________________________________。
(3)滤渣1的成分为________。

(4)“制KI(aq)”时,Fe2+会水解形成胶状物吸附KI,造成I-的损失。已知此温度下,Kw=1.0×10-13,Ksp[Fe(OH)2]=9.0×10-15。现测得溶液中c(FeI2)为0.9 mol·L-1,为减少I-的损失,起始时,加入K2CO3必须保持FeI2溶液的pH不大于________。
(5)“制KIO3溶液”时,发生反应的离子方程式为_______________________________。
(6) KCl、KIO3的溶解度曲线如图所示。由KIO3溶液得到KIO3晶体的方法为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示物质间不满足每一步转化均能实现的是( )
A. N2(g)![]() NO(g)
NO(g)![]() NaNO2(aq)
NaNO2(aq)
B. SiO2![]() Na2SiO3
Na2SiO3![]() H2SiO3
H2SiO3
C. Al![]() NaAlO2
NaAlO2![]() Al(OH)3
Al(OH)3
D. Fe3O4(s)![]() Fe(s)
Fe(s)![]() Fe(NO3)3(aq)
Fe(NO3)3(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[物质结构与性质]
高温炼铜的反应之一为2CuFeS2+O2![]() Cu2S+2FeS+SO2。
Cu2S+2FeS+SO2。
(1) Cu+基态核外电子排布式为________________。

(2) Cu、Zn的第二电离能:I2(Cu)________(填“>”“<”或“=”)I2(Zn)。
(3) SO2分子中S原子的轨道杂化类型为________,分子的空间构型为________,与SO2互为等电子体的分子有________(写一种)。
(4) [Cu(CH3CN)4]+是非常稳定的络合离子,配体中σ键和π键个数之比为________。
(5) Fe2+、Fe3+能与CN-络合,其结构如图所示。该离子可形成铁蓝钾盐,该钾盐的化学式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,将22.4LHCl完全溶于1L水中(水的密度近似为1g/mL),溶液的密度为ρg/cm3(ρ>1),溶液的体积为VmL,溶质的质量分数为w,溶质的物质的量浓度为c mol/L。下列叙述中正确的是
①w=![]() ×100% ②c=1molL﹣1 ③向上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5w④向上述溶液中再加入VmL水后,所得溶液的质量分数小于0.5w
×100% ②c=1molL﹣1 ③向上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5w④向上述溶液中再加入VmL水后,所得溶液的质量分数小于0.5w
A.①②B.②③C.①③D.①④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com