
【题目】聚合氯化铝晶体([Al2(OH)nCl(6-n)XH2O]m)是一种高效无机水处理剂。它的制备原理是调节AlCl3溶液的pH,通过促进其水解而结晶析出。
回答下列问题:
(1)铝原子核外能量最高的电子有_____个。分析AlCl3熔点较低的原因(熔点:AlCl3—194℃,Al2O3—2054℃,NaCl—801℃)。____________________________________________________
(2)比较聚合氯化铝晶体中同周期两种元素的原子半径,并用原子结构知识说明理由。___________
(3)铝灰(主要成分为Al、Al2O3,另有少量CuO、SiO2、FeO和Fe2O3杂质)可制备AlCl3,如果先除去铝灰中的金属氧化物杂质可选用__________(选填:“强碱”或“强酸”)。写出其中Al发生反应的离子方程式_______________________________。
(4)制备聚合氯化铝晶体,需严格控制溶液的pH在4.0~4.5才能使产率达到最大。结合AlCl3水解的离子方程式,用化学平衡移动原理解释控制pH在4.0~4.5之间的原因_______________________________
【答案】1 AlCl3是分子晶体,分子间以较弱的分子间作用力结合 Al>Cl;Al和Cl原子核外电子层数相同,Al比Cl的核电荷数小,核对外层电子的吸引力也小,所以半径也小 强碱 2OH-+2Al+2H2O→2AlO2-+3H2↑ Al3++3H2O![]() Al(OH)3+3H+;pH太小,氯化铝的水解平衡向左移动,产率减小;pH太大则水解平衡向右移动,生成氢氧化铝沉淀,产率也会下降
Al(OH)3+3H+;pH太小,氯化铝的水解平衡向左移动,产率减小;pH太大则水解平衡向右移动,生成氢氧化铝沉淀,产率也会下降
【解析】
(1)根据Al原子的核外电子排布1s22s22p63s23p1可得;AlCl3是分子晶体,熔沸点低;
(2)聚合氯化铝晶体中同周期两种元素的原子为Al和Cl,电子层数均为3,核外电子数不同,原子核对核外电子的吸引力不同;
(3)铝灰(主要成分为Al、Al2O3,另有少量CuO、SiO2、FeO和Fe2O3杂质)可制备AlCl3,只有Al、Al2O3溶于强碱生成偏铝酸盐,与金属氧化物杂质分离,再将偏铝酸盐用盐酸酸化得AlCl3;
(4)AlCl3水解的离子方程式为Al3++3H2O![]() Al(OH)3+3H+,根据酸碱性对平衡的影响分析。
Al(OH)3+3H+,根据酸碱性对平衡的影响分析。
(1)Al核电荷数为13,具有3个电子层,最外层电子数为3,核外电子排布式为:1s22s22p63s23p1,3p为能量最高的轨道,只有一个电子;AlCl3是分子晶体,分子间作用力较弱,故AlCl3熔点较低;
(2)聚合氯化铝晶体中同周期两种元素的原子为Al和Cl,Al和Cl原子核外电子层数相同,Al比Cl的核电荷数小,核对外层电子的吸引力也小,所以半径也小,故Al>Cl;
(3)铝灰中只有Al、Al2O3溶于强碱生成偏铝酸盐,与金属氧化物杂质分离,发生的反应为:2OH-+2Al+2H2O→2AlO2-+3H2↑;
(4)AlCl3水解的离子方程式为:Al3++3H2O![]() Al(OH)3+3H+,pH太小,氯化铝的水解平衡向左移动,产率减小,pH太大则水解平衡向右移动,生成氢氧化铝沉淀,产率也会下降,故需需严格控制溶液的pH;
Al(OH)3+3H+,pH太小,氯化铝的水解平衡向左移动,产率减小,pH太大则水解平衡向右移动,生成氢氧化铝沉淀,产率也会下降,故需需严格控制溶液的pH;


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列氧化还原反应中,水作为氧化剂的是( )
A. CO+H2O![]() CO2+H2B. CuO+H2
CO2+H2B. CuO+H2![]() Cu+H2O
Cu+H2O
C. 2F2+2H2O═4HF+O2D. 3NO2+H2O═2HNO3+NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种短周期元素,它们的原子序数依次增大。B原子的最外层电子数是其次外层电子数的2倍。A的一种原子中,质量数与质子数之差为零。D元素原子的最外层电子数为m,次外层电子数为n。E元素原子的L层上电子数为(m+n),M层上电子数为![]() 。请回答下列问题:
。请回答下列问题:
(1)B元素是________,D元素在周期表中的位置是________。
(2)C与E形成的化合物E3C属于________(填“原子”“离子”或“分子”)晶体。
(3)由A、D、E元素组成的化合物中存在的化学键类型是________。
(4)写出一个E和D形成的化合物与水反应的离子方程式:_________________________。
(5)已知:甲+H2O→丙+丁,该反应不是氧化还原反应。若甲是由N和Cl元素组成的化合物,其分子结构模型如下图所示,丙具有漂白性。丁与H2O有相同的电子总数,则丁的电子式为_________________。

(6)与D同主族且上下相邻的元素M、N,原子电子层数M>N>D,三种元素的氢化物的稳定性由大到小的顺序是________________________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物N(![]() )是一种常见的有机合成中间体,在生产中用途广泛。
)是一种常见的有机合成中间体,在生产中用途广泛。
有机物A为原料合成M和N的路线如下所示:

已知:I.R-CH=CH2+HBr ![]() R-CH2CH2Br
R-CH2CH2Br
II.R-CH2-CN![]() R-CH2-COOH
R-CH2-COOH ![]()
![]()
请回答下列问题:
(1)A分子中共面的原子数最多为___________个,-CN的电子式为___________。
(2)②的反应类型为___________,E分子中所含官能团的名称为___________,G的结构简式为______________________。
(3)写出反应⑤的化学方程式__________________________。
(4)写出M在酸性条件下水解的化学方程式______________________。
(5)D的同分异构体中,能发生银镜反应,且能与钠反应放出H2的共有___________种,写出核磁共振氢谱有4组峰,且峰面积比为1:1:2:6的一种同分异构体的结构简式:___________。
(6)结合信息,写出用E和乙醇为原料制备化合物N的合成路线:(其他试剂任选)___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析图,甲、乙具有的共性是
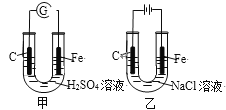
A. 反应物能量均高于生成物能量
B. 电极反应均有Fe-2e→Fe2+
C. 碳棒上均发生氧化反应
D. 溶液pH均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚乳酸E在服装、卫生医疗制品等行业具有广泛的应用。某有机化合物A在一定条件下通过一系列反应可合成E;同时还可得到C和D等重要有机化合物。转化关系如下图:

完成下列填空:
(1)B→E反应类型:_____________, D→G实验室中反应条件:________________。
(2)A的分子式:___________________。
(3)与F同类别的同分异构体还有HCOOCH(CH3)2 、HCOOCH2CH2CH3和______________(用结构简式表示)。
(4)写出实验室中判断D中有G生成的方法___________________________________________________ (5)石油产品丙烯及必要的无机试剂可合成丙烯酸,设计合成路线如下:CH3CH=CH2![]() ClCH2CH=CH2→甲→乙→丙
ClCH2CH=CH2→甲→乙→丙![]() 丙烯酸
丙烯酸
已知:
i.![]()
请完成合成路线中的:ClCH2CH=CH2→甲→乙→丙____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用化学用语表示Na2CO3+2Cl2===2NaCl+Cl2O+CO2中的相关微粒,其中正确的是( )
A. Na+的结构示意图:![]()
B. Cl2O的结构式:Cl—O—Cl
C. 中子数比质子数多3的氯原子:3517Cl
D. CO2的电子式:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烟气(主要污染物SO2、NOX)经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中的SO2、NOx 的含量。
(1) O3氧化烟气中SO2、NOx 的主要反应的热化学方程式为: NO(g)+O3(g)![]() NO2(g)+ O2(g) ΔH=-200.9 kJ·mol-13NO(g)+O3(g)
NO2(g)+ O2(g) ΔH=-200.9 kJ·mol-13NO(g)+O3(g)![]() 3NO2(g) ΔH=-317.3kJ·mol-1。则2NO2(g)
3NO2(g) ΔH=-317.3kJ·mol-1。则2NO2(g)![]() 2NO(g)+O2(g)的ΔH=_____________kJ·mol-1
2NO(g)+O2(g)的ΔH=_____________kJ·mol-1
(2)T℃时,利用测压法在刚性反应器中,投入一定量的NO2发生反应3NO2(g)![]() 3NO(g)+O3(g),体系的总压强 p随时间 t的变化如下表所示:
3NO(g)+O3(g),体系的总压强 p随时间 t的变化如下表所示:
反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
压强/MPa | 20.00 | 21.38 | 22.30 | 23.00 | 23.58 | 24.00 | 24.00 |
①若降低反应温度,则平衡后体系压强 p______24.00 MPa(填“>”、“<”或“=”),原因是____________。
②15min 时,反应物的转化率 α=______。
③T℃时反应3NO2(g)![]() 3NO(g)+O3(g)的平衡常数Kp=____________(Kp 为以分压表示的平衡常数,分压等于总压乘以该气体的物质的量分数)
3NO(g)+O3(g)的平衡常数Kp=____________(Kp 为以分压表示的平衡常数,分压等于总压乘以该气体的物质的量分数)
(3)T℃时,在体积为2L的密闭刚性容器中,投入2 mol NO2发生反应2NO2(g)![]() 2NO(g)+O2(g),实验测得:v正=k正 c2(NO2),v逆=k逆 c2(NO)·c(O2),k正、k逆为速率常数,受温度影响。在温度为T℃时NO2的转化率随时间变化的结果如图所示(反应在5.5min时达到平衡):
2NO(g)+O2(g),实验测得:v正=k正 c2(NO2),v逆=k逆 c2(NO)·c(O2),k正、k逆为速率常数,受温度影响。在温度为T℃时NO2的转化率随时间变化的结果如图所示(反应在5.5min时达到平衡):

①在体积不变的刚性容器中,投入固定量的NO2发生反应,要提高NO2转化率,可采取的措施是______________、___________。
②由图中数据,求出该反应的平衡常数为_________。
③计算A 点处v正/v逆=_________________________(保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用某分子筛作催化剂,NH3可脱除废气中的NO和NO2,生成两种无毒物质,其反应历程如下图所示,下列说法正确的是
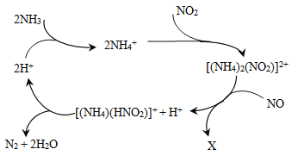
A. X是N2
B. 上述历程的总反应为:2NH3+NO +NO2![]() 2N2+3H2O
2N2+3H2O
C. NH4+中含有非极性共价键
D. NH3、NH4+、H2O中的质子数、电子数均相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com