
����Ŀ���л���N(![]() )��һ�ֳ������л��ϳ��м��壬����������;�㷺��
)��һ�ֳ������л��ϳ��м��壬����������;�㷺��
�л���AΪԭ�Ϻϳ�M��N��·��������ʾ��

��֪��I.R-CH=CH2+HBr ![]() R-CH2CH2Br
R-CH2CH2Br
II.R-CH2-CN![]() R-CH2-COOH
R-CH2-COOH ![]()
![]()
��ش��������⣺
(1)A�����й����ԭ�������Ϊ___________������CN�ĵ���ʽΪ___________��
(2)�ڵķ�Ӧ����Ϊ___________��E���������������ŵ�����Ϊ___________��G�Ľṹ��ʽΪ______________________��
(3)д����Ӧ�ݵĻ�ѧ����ʽ__________________________��
(4)д��M������������ˮ��Ļ�ѧ����ʽ______________________��
(5)D��ͬ���칹���У��ܷ���������Ӧ���������Ʒ�Ӧ�ų�H2�Ĺ���___________�֣�д���˴Ź���������4��壬�ҷ������Ϊ1��1��2��6��һ��ͬ���칹��Ľṹ��ʽ��___________��
(6)�����Ϣ��д����E���Ҵ�Ϊԭ���Ʊ�������N�ĺϳ�·�ߣ�(�����Լ���ѡ)___________��
���𰸡�8 ![]() ȡ����Ӧ �Ȼ�����ԭ��
ȡ����Ӧ �Ȼ�����ԭ�� ![]()
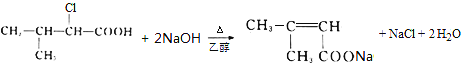
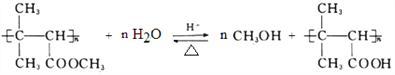 12
12 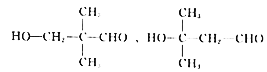
��������
���ݷ�Ӧ���֪A�к���̼̼����A�Ļ�ѧʽΪC4H8������ϩ������D��֪A�к���2��������B�Ļ�ѧʽ��֪AΪCH3C(CH3)=CH2��BΪ(CH3)2CHCH2Br��CΪ(CH3)2CHCH2CN������Ϣ���֪EΪ(CH3)2CHCHClCOOH����M��֪GΪ(CH3)2C=CHCOOCH3��FΪ(CH3)2C=CHCOOH���Դ˽����⡣
(1)��������������֪AΪCH3C(CH3)=CH2�������к���̼̼˫������̼̼˫��ֱ��������ԭ����ͬһ��ƽ���ϣ���̼̼˫�����˸���3��ԭ�ӣ�������������1��Hԭ�ӿ�����̼̼˫�������ƽ���ϣ�һ�������8��ԭ�ӹ�ƽ�棬-CN�ĽṹΪ-C��N������ʽΪ![]() ��
��
(2)�ڵķ�ӦΪ-CN���Br����Ӧ����Ϊȡ����Ӧ��EΪ(CH3)2CHCHClCOOH�����еĹ�����Ϊ�Ȼ�����ԭ�ӣ�G�Ľṹ��ʽΪ(CH3)2C=CHCOOCH3��
(3)��Ӧ��Ϊ(CH3)2CHCHClCOOH�����������Ҵ���Һ�е���ȥ��Ӧ������ʽΪ(CH3)2CHCHClCOOH +2NaOH![]() (CH3)2C=CHCOONa+NaCl+2H2O��
(CH3)2C=CHCOONa+NaCl+2H2O��
(4)MΪ�ۺ��ˮ��ķ���ʽΪ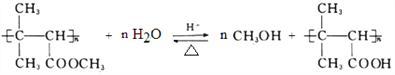 ��
��
(5)D��ͬ���칹���У��ܷ���������Ӧ���������Ʒ�Ӧ�ų�H2��˵��D��ͬ���칹������к���ȩ�����ǻ����ɿ���ȩ�����ǻ�ȡ�������Hԭ�ӣ���������CH3CH2CH2CH3��CH3CH(CH3)2���֣��ȷ���̼�Ǽ��칹���ֱ�Ϊ��C-C-C-C ��![]() 2�������Ȼ��ֱ��2 ��̼�Ǽܲ�������һ��һ���ķ������������йǼ� C-C-C-C ��
2�������Ȼ��ֱ��2 ��̼�Ǽܲ�������һ��һ���ķ������������йǼ� C-C-C-C ��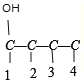 ��
��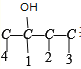 �� 8 �֣��Ǽ���
�� 8 �֣��Ǽ���![]() ����
����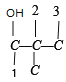 ��
�� 4 �֣���˹�12��ͬ���칹�壬���к˴Ź���������4��壬�ҷ������Ϊ1��1��2��6��ͬ���칹����
4 �֣���˹�12��ͬ���칹�壬���к˴Ź���������4��壬�ҷ������Ϊ1��1��2��6��ͬ���칹����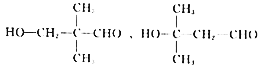 ��
��
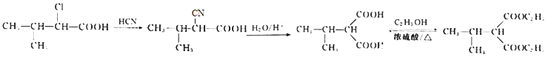
(6)EΪ(CH3)2CHCHClCOOH����E���Ҵ�Ϊԭ���Ʊ�������N������ʹ(CH3)2CHCHClCOOH��HCN����ȡ����Ӧ����(CH3)2CHCH(CN)COOH��Ȼ��������������ˮ������(CH3)2CHCH(COOH)2������Ũ����������ʹ(CH3)2CHCH(COOH)2���Ҵ�����������Ӧ������![]() ����ϳ�·��Ϊ
����ϳ�·��Ϊ ��
��


 ��ս�п�����ϵ�д�
��ս�п�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�ϡ����Ͱ�ˮ����ͬ����Ȼ�ϵõ�������Һ����ȡ20mL��Һ����0.1molL��1NaOH��Һ�ζ�����Һ��pH��NaOH��Һ������仯��ͼ��ʾ������˵����ȷ���ǣ� ��

A. ����pH��7ʱ��������Һ�о�����c��Na+����c��Cl����
B. ԭ�����Ũ����0.1molL��1
C. V��NaOH����10mL����Һ��Na+Ũ��a��b
D. ��V��NaOH����20mLʱ��������Һ��pH��ͬ����Һ�е�NH4+Ũ�Ƚ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ij������ľ�������������С��Ԫ���öѻ����ɵ�,���ڸû���������������д������

![]()
A. 1 mol�û���������1 mol Y B. 1 mol�û���������1 mol Ba
C. 1 mol�û���������7 mol O D. �û�����Ļ�ѧʽ��YBa2Cu3O7
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ȩ��Ũ����������Һ�з���Cannizzaro��Ӧ����Ӧ����ʽ���£��������Ʊ�������ͱ��״���
2![]() +KOH
+KOH![]()
![]() \
\
![]() +HCl
+HCl![]()
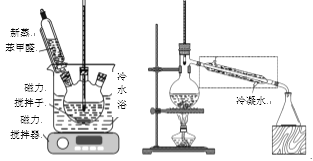
��֪��
����������ˮ�����л������õ��ܼ����е�34.6�棬���ӷ����ڿ����еķе�160�档
�ڱ�������ˮ�е��ܽ��0.17g(25��),0.95g(50��),6.8g(95��)
ʵ�鲽�裺
����50mL����ƿ�м���4.5g KOH��4.5mLˮ����װ��������ˮԡ�У���������������������5mL ��������ȩ(�ܶ�1.04g/mL)��ʹ��Ӧ���ֻ��(������ͼ)������Ϊ��ɫ��״�����24h���ϡ�
����Ӧ���������������ˮ����ʹ����ȫ�ܽ����_____(��װ������)�У���10mL ������ȡ3�Σ��ϲ�������ȡҺ����������3mL�������������ơ�5mL 10% Na2CO3��Һ��5mLˮϴ�ӣ��ֳ������Ѳ�����ˮNa2CO3���
�۸�����������Һ��ˮԡ����ȥ���ѣ�Ȼ���ʵ���������װ��(������ͼ)���������������ռ�198�桫204��ı��״���֣�����Ϊ2.16g��
��������ȡ���ˮ��Һ(ˮ��)����Ũ�����ữ�������ȴ��ʹ��������ȫ���������ˣ��ֲ�Ʒ��ˮ�ؽᾧ�õ������ᣬ������2g��
(1)���Ͻ���Ȼ�����24h��Ŀ����____________________________________
(2)����ں��ߴ�װ��������___________________________
(3)��ȡҺ��ϴ����3�Σ�����10% ̼������Һ����ȥ��������_______(�ѧʽ)

(4)ʹ��ˮԡ��ȥ���ѵ��ŵ���_____________
(5)��ȥ���Ѻ��ʵ��ĵ�������װ�ã�Ӧ������ͼ���߿��е�װ�û�Ϊ________��
(6)�������ؽᾧʱ��������ˮϴ�ӹ��壬��Ŀ����______���������ؽᾧʱ����IJ���������__________________
���ձ� ���Թ� ����ƿ �ܾƾ��� ����Ͳ �̾�����©�� �߲�����
(7)��ʵ����Cannizzaro��Ӧ��ת������_____%(����1λС��)��ͨ������ʵ���б�����IJ��ʻ�ȱ��״����ͣ�������ij��ʵ���в�δ����ƿ�������±�����IJ�������ƫ�ߣ��������ܵ�ԭ����__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵�����ʾ������ȷ����( )
A. �����������������������ֱ���ȫȼ��,���߷ų�������
B. ��C(ʯī)=C(���ʯ)��H=+1.9 kJ��mol-1��֪,���ʯ��ʯī�ȶ�
C. ��101kPaʱ,2g H2��ȫȼ������Һ̬ˮ,�ų�285.8kJ����,����ȼ�յ��Ȼ�ѧ����ʽ��ʾΪ2H2(g)+O2(g)![]() 2H2O(l) ��H=+285.8 kJ��mol-1
2H2O(l) ��H=+285.8 kJ��mol-1
D. ��ϡ��Һ��:H++OH-![]() H2O ��H=-57.3 kJ��mol-1,������1mol CH3COOH�뺬1mol NaOH����Һ���,�ų�������С��57.3 kJ
H2O ��H=-57.3 kJ��mol-1,������1mol CH3COOH�뺬1mol NaOH����Һ���,�ų�������С��57.3 kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܱ������е�һ����������巢����Ӧ��x A(g) + y B(g) ![]() z C(g)��ƽ��ʱ���A��Ũ��Ϊ0.5 mol/L�������¶Ȳ��䣬���������ݻ�����ԭ�����������ٴδﵽƽ��ʱ�����A��Ũ�Ƚ���Ϊ0.3 mol/L�������й��ж���ȷ���ǣ� ��
z C(g)��ƽ��ʱ���A��Ũ��Ϊ0.5 mol/L�������¶Ȳ��䣬���������ݻ�����ԭ�����������ٴδﵽƽ��ʱ�����A��Ũ�Ƚ���Ϊ0.3 mol/L�������й��ж���ȷ���ǣ� ��
A��x + y < z B��B��ת���ʽ���
C��ƽ��������Ӧ�����ƶ� D��C�������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ۺ��Ȼ�������([Al2(OH)nCl(6-n)XH2O]m)��һ�ָ�Ч��ˮ�������������Ʊ�ԭ���ǵ���AlCl3��Һ��pH��ͨ���ٽ���ˮ����ᾧ������
�ش��������⣺
(1)��ԭ�Ӻ���������ߵĵ�����_____��������AlCl3�۵�ϵ͵�ԭ��(�۵㣺AlCl3��194�棬Al2O3��2054�棬NaCl��801��)��____________________________________________________
(2)�ȽϾۺ��Ȼ���������ͬ��������Ԫ�ص�ԭ�Ӱ뾶������ԭ�ӽṹ֪ʶ˵�����ɡ�___________
(3)����(��Ҫ�ɷ�ΪAl��Al2O3����������CuO��SiO2��FeO��Fe2O3����)���Ʊ�AlCl3������ȳ�ȥ�����еĽ������������ʿ�ѡ��__________(ѡ���ǿ��������ǿ����)��д������Al������Ӧ�����ӷ���ʽ_______________________________��
(4)�Ʊ��ۺ��Ȼ������壬���ϸ������Һ��pH��4.0��4.5����ʹ���ʴﵽ����AlCl3ˮ������ӷ���ʽ���û�ѧƽ���ƶ�ԭ�����Ϳ���pH��4.0��4.5֮���ԭ��_______________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڸ��������£�����ѡ����ʾ���ʼ䲻����ÿһ��ת������ʵ�ֵ���(����)
A. N2(g)![]() NO(g)
NO(g)![]() NaNO2(aq)
NaNO2(aq)
B. SiO2![]() Na2SiO3
Na2SiO3![]() H2SiO3
H2SiO3
C. Al![]() NaAlO2
NaAlO2![]() Al(OH)3
Al(OH)3
D. Fe3O4(s)![]() Fe(s)
Fe(s)![]() Fe(NO3)3(aq)
Fe(NO3)3(aq)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʽ������[Fe(OH)SO4 ]��һ������Ч����������������ˮ��������ҽ����Ҳ���������������������Ѫ����ҵ�����÷���м(��������������)������ʽ�������Ĺ�������������ʾ��

����������������������ʽ����ʱ��Һ��pH�����ʾ��
������ | Fe(OH) 3 | Fe(OH) 2 | Al(OH) 3 |
��ʼ���� | 2.3 | 7.5 | 3.4 |
��ȫ���� | 3.2 | 9.7 | 4.4 |
��ش��������⣺
��1����������NaHCO3 ��Ŀ���ǵ�����Һ��pH����ȥAl3�� ����pH�ķ�Χ__________����д�����ܷ��������ӷ���ʽ��________________��
��2����ʵ�������У���Ӧ���г�ͬʱͨ��O2 ���Լ���NaNO2 ��������O2 ��NaNO2 �ڷ�Ӧ�о���__________�������뷴Ӧ��O2 ��11.2 L(��״��)�����൱�ڽ�ԼNaNO2 �����ʵ���Ϊ________��
��3����ʽ����������ˮ�������Fe(OH)2�� �ɲ���ˮ������Fe2(OH)42������ˮ�ⷴӦ�����ӷ���ʽΪ________________________________________________________________�� Fe(OH)3 ��Ksp =____________������ʾ����ʼ����c(Fe 3+ )Ũ��Ϊ1.0��10 -5 mol/L��
��4����ҽҩ�ϳ����������������ᡢ����Ļ��Һ��Ӧ�Ʊ���ʽ�������������ҹ�����������Ʒ�в��ú���Fe2�� ��NO3����Ϊ�������õIJ�Ʒ���Ƿ���Fe2�� ��Ӧʹ�õ��Լ�Ϊ________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com