
【题目】下列氧化还原反应中,水作为氧化剂的是( )
A. CO+H2O![]() CO2+H2B. CuO+H2
CO2+H2B. CuO+H2![]() Cu+H2O
Cu+H2O
C. 2F2+2H2O═4HF+O2D. 3NO2+H2O═2HNO3+NO
 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】在如图所示电解质溶液的导电性装置中,若向某一电解质溶液中滴加另一种溶液或通入某种气体时,则灯光由亮变暗至熄灭后又逐渐变亮的是( )
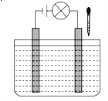
A.盐酸中逐滴加入食盐溶液
B.醋酸中逐滴加入氢氧化钠溶液
C.饱和石灰水中不断通入CO2
D.醋酸中逐滴加入氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三种常见单萜类化合物的结构如下图所示。下列说法正确的是( )
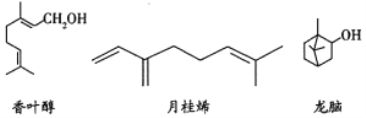
A. 香叶醇和龙脑互为同分异构体,分子式均为![]()
B. 可用金属钠鉴别香叶醇和月桂烯
C. 龙脑分子中所有碳原子在同一个平面上
D. 1mol月桂烯最多能与![]() 发生加成反应
发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将NaOH溶液滴入二元弱酸H2X溶液中,混合溶液中的粒子浓度与溶液pH的变化关系如下图所示。下列叙述正确的是( )

A. 曲线M表示![]() 与pH的变化关系
与pH的变化关系
B. NaHX溶液显碱性
C. 当混合溶液呈中性时,![]()
D. ![]() 的数量级为
的数量级为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物H是合成某种药物的中间体,一种合成路线如下:

回答下列问题:
(1)有机物B的化学名称为______。
(2)反应②的反应类型为______。
(3)反应④所需试剂、条件分别为______。
(4)写出反应③的化学方程式______。
(5)1molE与1molH2完全加成生成1molW,W有多种同分异构体,其中属于α-氨基酸、分子中含两个羧基、且苯环上有两个取代基的W的可能结构共有______种(不考虑立体异构),其中核磁共振氢谱为五组峰,峰面积比为3:2:2:2:2的结构简式为______。
(6)设计以甲苯和(CH3CO)2O为原料制备 的合成路线______(无机试剂任选)。
的合成路线______(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟化钡可用于制造电机电刷、光学玻璃、光导纤维、激光发生器。以钡矿粉(主要成分为BaCO3,含有SiO2、Fe2+、Mg2+等杂质)制备氟化钡的流程如下:
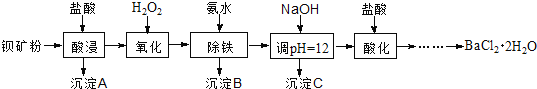
已知:常温下Fe3+、Mg2+完全沉淀的pH分别是:3.4、12.4。
(1)滤渣A的名称为___________。
(2)滤液1加H2O2的目的是___________。
(3)加NaOH溶液调节pH=12.5,得到滤渣C的主要成分是___________(写化学式)
(4)滤液3加入盐酸酸化后再经加热浓缩____________洗涤,真空干燥等一系列操作后得到BaCl2·2H2O晶体。
(5)常温下,用BaCl2·2H2O配制成0.2 mol/L水溶液与氟化铵溶液反应,可得到氟化钡沉淀。请写出该反应的离子方程式___________。已知Ksp(BaF2)=1.84×10-7,当钡离子完全沉淀时(即钡离子浓度≤10-5 mol/L),至少需要的氟离子浓度是___________mol/L(已知![]() =1.36,计算结果保留三位有效数字)。
=1.36,计算结果保留三位有效数字)。
(6)5.0 t含80%BaCO3的钡矿粉,理论上最多能生成BaCl2·2H2O晶体___________t 。(保留2位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中A~H均为中学化学中常见的物质,A、B、H为气体,反应①是重要的工业反应,它们之间有如下转化关系(反应中生成的水已略去)。

请回答以下问题:
(1)B是_____,D是_____,G是_____,H是_____(填化学式)。
(2)工业上常利用反应①制取漂白粉,该反应的化学方程式:__________,漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为_________。
(3)A中元素的原子结构示意图为________。
(4)F在溶液中的电离方程式为_________。
(5)上述反应中属于氧化还原反应的是_______(填写序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】填空题。
(1)47.5g某二价金属的氯化物中含有1molCl-,则该金属氯化物的摩尔质量为_______ ;该金属的相对原子质量为_______ 。
(2)标准状况下,3.4g NH3 的体积为_______ ;它与标准状况下_______ L H2S含有相同数目的氢原子。
(3)已知CO、CO2混合气体的质量共10.0g,在标准状况下的体积为6.72L,则混合气体中CO的质量为_______ ;CO2在相同状况下的体积为_______ 。
(4)将4g NaOH 溶解在10mL水中,再稀释成1L,从中取出10mL,这10mL溶液的物质 的量浓度为_______。
(5)已知ag氢气中含有b个氢原子,则阿伏加德罗常数的值可表示为 _______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某晶体的晶胞结构为正三棱柱(如图所示),这种晶体中A、B、C三种微粒数目之比为

A. 2∶9∶4 B. 3∶9∶4
C. 1∶4∶2 D. 3∶8∶4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com