
【题目】在如图所示电解质溶液的导电性装置中,若向某一电解质溶液中滴加另一种溶液或通入某种气体时,则灯光由亮变暗至熄灭后又逐渐变亮的是( )
A.盐酸中逐滴加入食盐溶液
B.醋酸中逐滴加入氢氧化钠溶液
C.饱和石灰水中不断通入CO2
D.醋酸中逐滴加入氨水
【答案】C
【解析】
A.盐酸溶液中逐滴加入食盐,溶液中一直有电解质电离产生的自由移动的离子,灯泡不会熄灭,选项A错误;
B.醋酸中逐滴加入氢氧化钠溶液会生成醋酸钠,溶液中也一直有可溶性的电解质电离,自由移动的电荷一直存在,因此灯泡不会熄灭,选项B错误;
C.饱和石灰水中不断通入CO2,随着CO2的通入,不断生成碳酸钙沉淀,使自由移动的电荷浓度逐渐减小,灯光逐渐变暗,当完全二者恰好反应生成碳酸钙和水时,溶液中电荷浓度接近0,灯泡熄灭,再通入CO2时,生成可溶的Ca(HCO3)2,电荷浓度逐渐增大,灯泡逐渐变亮,选项C正确;
D.醋酸中逐滴加入氨水,生成醋酸铵,弱电解质变为强电解质,自由移动的离子浓度逐渐增大,溶液电荷浓度不为0,灯泡不可能熄灭,选项D错误。
答案选C。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】燃煤及工业废气中的SO2是形成酸雨的主要原因,消除SO2是减少酸雨形成的有效方法。完成下列问题:
(1)已知:4FeS2(s)+11O2(g)═2Fe2O3(s)+8SO2(g)△H=﹣3412.0kJmol﹣1
Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=﹣25.0 kJmol﹣1
2C(s)+O2(g)═2CO(g)△H=﹣221.0 kJmol﹣1
则2FeS2(s)+7O2(g)+3C(s)═2Fe(s)+3CO2(g)+4SO2(g)△H=_____kJmol﹣1。
(2)碱性NaClO2溶液脱硫法
SO2与碱性NaClO2溶液反应的离子方程式为2SO2+ClO2﹣+4OH﹣2SO42﹣+C1﹣+2H2O,已知pc=﹣lgc(SO2)。在刚性容器中,将含SO2的废气通入碱性NaClO2溶液中,测得pc与温度的关系如图所示。
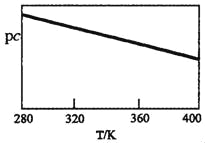
由图分析可知,该脱硫反应是_____反应(填“放热”或“吸热”);若温度不变,增大压强,该脱硫反应的平衡常数K_____(填“增大”、“减小”或“不变”)。
(3)燃料细菌脱硫法
①含FeS2的燃煤可用氧化亚铁硫杆菌(T.f)、氧化亚铁微螺菌(L.f)、氧化硫硫杆菌(T.t)进行脱硫,其脱硫过程如图所示:
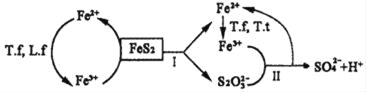
已知:脱硫总反应为:FeS2+14Fe3++8H2O═2SO42﹣+15Fe2++16H+,
Ⅰ反应的化学方程式为:FeS2+6Fe3++3H2O═S2O32﹣+7Fe2++6H+;
写出Ⅱ反应的化学方程式_____。
②在上述脱硫反应中,氧化亚铁硫杆菌(T.f)与Fe3+的形成过程可视为下图所示的原电池:

该细胞膜为_____(填“阳离子交换膜”或“阴离子交换膜”)。该电池的正极电极反应式为_____。该方法在高温下脱硫效率大大降低,原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇、氧气和强碱溶液作电解质的手机电池中的反应为2CH3OH+3O2+40H-![]() 2CO32-+6H2O,有关说法正确的是
2CO32-+6H2O,有关说法正确的是
A. 放电时,CH3OH 参与反应的电极为正极
B. 放电时,负极电极反应:CH3OH+8OH--6e-=CO32-+6H2O
C. 标准状况下,通入的11.2LO2完全反应有1mol电子转移
D. 充电时电解质溶液的pH逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物Z是合成平喘药沙丁胺醇的中间体,可通过下列路线制得:

下列说法正确的是
A. 1 mol Z最多能与2 mol NaOH反应
B. Y可以发生取代反应、氧化反应、消去反应
C. 可用FeCl3溶液鉴别Y和Z
D. X分子中所有原子在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将下列各组物质,按单质、氧化物、酸、碱、盐分类顺序排列正确的是( )
A.银、二氧化硫、硫酸、烧碱、食盐
B.碘酒、冰、硫酸氢钠、烧碱、碳酸钙
C.氢气、干冰、硝酸、烧碱、硝酸钾
D.铜、氧化铜、醋酸、石灰水、碳酸氢钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
I.CO 还原NO 的脱硝反应:2CO(g)+2NO(g) 2CO2(g)+N2(g) △H
(1)已知:CO(g)+NO2(g) CO2(g)+NO(g) △H1=-226 kJ·mol-1
N2(g)+2O2(g) 2NO2(g) △H2=+68 kJ·mol-1
N2(g)+O2(g) 2NO(g) △H3=+183 kJ·mol-1
脱硝反应△H=__________,有利于提高NO 平衡转化率的条件是________________(写出两条)。
(2)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题。某研究小组在实验室以Ag-ZSM-5为催化剂,对CO、NO催化转化进行研究,测得NO转化为N2的转化率随温度、CO混存量的变化情况如下图所示,

①若不使用CO,温度超过775℃,发现NO的分解率降低,其可能的原因为_________________;在n(NO)/n(CO)=1的条件下,应控制最佳温度在____________左右。
②用CxHy(烃)催化还原NOx也可消除氮氧化物的污染,写出C2H6与NO2发生反应的化学方程式:_________。
③NO2尾气常用NaOH溶液吸收,生成NaNO3和NaNO2。已知NO2-的水解常数K=2×10-11,常温下某NaNO2和HNO2混合溶液的pH为5,则混合溶液中c(NO2-)和c(HNO2)的比值为__________。
II.T ℃时,在刚性反应器中发生如下反应:CO(g)+NO2(g) CO2(g)+NO(g),化学反应速率v =k Pm(CO)Pn(NO2),k 为化学反应速率常数。研究表明,该温度下反应物的分压与化学反应速率的关系如下表所示:

(3)若反应初始时P(CO)=P(NO2)=a kPa,反应t min时达到平衡,测得体系中P(NO)=b kPa,则此时v =___________ kPa·s-1(用含有a和b的代数式表示,下同),该反应的化学平衡常数Kp=_____(Kp是以分压表示的平衡常数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请完成下列填空:
(1)当NH3和N2H4所含分子数之比为1∶1时,其所含原子数之比为____,质量之比为____。
(2)现有m g某气体A,其摩尔质量为M g·mol-1。
①气体A在标准状况下的体积为____L
②A溶于水后形成V L溶液(A与水不反应),所得溶液的物质的量浓度为____ mol·L-1。
(3)将a mL 2 mol·L-1的Mg(NO3)2溶液稀释至b mL,稀释后溶液中NO3-的物质的量浓度为____mol/L
(4)一定体积的0.2 mol·L-1的BaCl2溶液,可使相同体积的Na2SO4溶液、KAl(SO4)2溶液、Fe2(SO4)3溶液3种溶液中的SO42-完全沉淀,则上述3种硫酸盐溶液的物质的量浓度比为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种从铜电解工艺的阳极泥中提取Se和Te的流程如下:
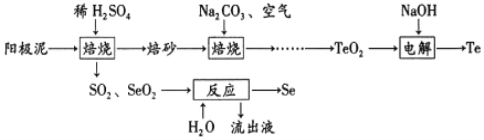
下列叙述错误的是( )
A. 合理处理阳极泥有利于保护环境和资源再利用
B. 流出液是H2SO4溶液
C. 电解过程中阴极上析出单质Te
D. “焙砂”与碳酸钠充分混合后,可在瓷坩锅中焙烧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列氧化还原反应中,水作为氧化剂的是( )
A. CO+H2O![]() CO2+H2B. CuO+H2
CO2+H2B. CuO+H2![]() Cu+H2O
Cu+H2O
C. 2F2+2H2O═4HF+O2D. 3NO2+H2O═2HNO3+NO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com