
【题目】化合物Z是合成平喘药沙丁胺醇的中间体,可通过下列路线制得:

下列说法正确的是
A. 1 mol Z最多能与2 mol NaOH反应
B. Y可以发生取代反应、氧化反应、消去反应
C. 可用FeCl3溶液鉴别Y和Z
D. X分子中所有原子在同一平面上
科目:高中化学 来源: 题型:
【题目】一定温度下在一容积不变的密闭容器中发生可逆反应2X(g)![]() Y(g)+Z(s),以下不能说明该反应达到化学平衡状态的是
Y(g)+Z(s),以下不能说明该反应达到化学平衡状态的是
A. 混合气体的密度不再变化 B. 反应容器中Y的质量分数不变
C. 体系压强不再变化 D. 2v逆(X)=v正(Y)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下四种气体:
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
(1)质量由大到小的顺序为____________。
(2)气体密度由大到小的顺序为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ca3(PO4)2与SiO2、C高温共热可以反应得到CaSiO3、P4蒸气和CO。反应如下:Ca3(PO4)2+SiO2+C![]() CaSiO3+P4↑+CO↑。
CaSiO3+P4↑+CO↑。
(1)配平该反应方程式,并标出电子转移方向和数目_____。
(2)该反应中被还原的元素是___,氧化产物是______。
(3)每消耗24.0g碳时,有___个电子发生转移,生成P4__g。
(4)反应所得混合气体,折算成标况下,其气体密度为____g/L(保留两位小数)。
(5)与该反应中涉及到的磷元素相同主族的氮元素,是造成水体富营养化的主要原因。若某污水中NH4Cl含量为180 mg/L。
①写出NH4Cl的电子式____。
②为除去废水中的NH4+,向103L该污水中加入0.1 mol/LNaOH溶液,发生如下反应:NH4++OH-=NH3+H2O,则理论上需要NaOH溶液的体积为___L(计算结果保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程或现象与盐类水解无关的是
A. 纯碱溶液去油污
B. 铁在潮湿的环境下生锈
C. 用氯化铁溶液制氢氧化铁胶体
D. 利用明矾溶液的酸性可清除铜制品表面的铜锈
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.1 molL1CH3COOH溶液中存在如下电离平衡:CH3COOH![]() CH3COO- + H+,对于该平衡,下列叙述正确的是
CH3COO- + H+,对于该平衡,下列叙述正确的是
A. 加热,平衡向逆反应方向移动
B. 加入少量0.05 molL﹣1 H2SO4溶液,溶液中c(H+)不变
C. 加入少量NaOH固体,平衡向正反应方向移动
D. 加入少量水,水的电离平衡不移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图所示电解质溶液的导电性装置中,若向某一电解质溶液中滴加另一种溶液或通入某种气体时,则灯光由亮变暗至熄灭后又逐渐变亮的是( )
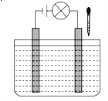
A.盐酸中逐滴加入食盐溶液
B.醋酸中逐滴加入氢氧化钠溶液
C.饱和石灰水中不断通入CO2
D.醋酸中逐滴加入氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌锰干电池的负极是作为电池壳体的金属锌,正极是被二氧化锰和碳粉包围的石墨电极,电解质是氯化锌和氯化铵的糊状物,该电池放电过程中产生 MnOOH。废旧电池中的Zn、Mn元素的回收,对环境保护有重要的意义。
Ⅰ. 回收锌元素,制备ZnCl2
步骤一:向除去壳体及石墨电极的黑色糊状物中加水,搅拌,充分溶解,经过滤分离得固体和滤液。
步骤二:处理滤液,得到ZnCl2·xH2O晶体。
步骤三:将SOCl2与ZnCl2·xH2O晶体混合制取无水ZnCl2。
制取无水ZnCl2,回收剩余的SOCl2并验证生成物中含有SO2(夹持及加热装置略) 的装置如下:

(已知: SOCl2是一种常用的脱水剂,熔点-105℃,沸点79℃,140℃以上时易分解,与水剧烈水解生成两种气体。)
(1)写出SOCl2与水反应的化学方程式:______________________。
(2)接口的连接顺序为a→___→___→ h → h →___→___→___→e。______________
Ⅱ. 回收锰元素,制备MnO2
(3)洗涤步骤一得到的固体,判断固体洗涤干净的方法:_________________________。
(4)洗涤后的固体经初步蒸干后进行灼烧,灼烧的目的__________________________。
Ⅲ. 二氧化锰纯度的测定
称取1.40g灼烧后的产品,加入2.68g草酸钠(Na2C2O4)固体,再加入足量的稀硫酸并加热(杂质不参与反应),充分反应后冷却,将所得溶液转移到100mL容量瓶中用蒸馏水稀释至刻线,从中取出20.00mL,用0.0200mol/L高锰酸钾溶液进行滴定,滴定三次,消耗高锰酸钾溶液体积的平均值为17.30mL。
(5)写出MnO2溶解反应的离子方程__________________________________________。
(6)产品的纯度为______________________ 。
(7)若灼烧不充分,滴定时消耗高锰酸钾溶液体积_____(填“偏大”、“ 偏小”、“ 不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将NaOH溶液滴入二元弱酸H2X溶液中,混合溶液中的粒子浓度与溶液pH的变化关系如下图所示。下列叙述正确的是( )

A. 曲线M表示![]() 与pH的变化关系
与pH的变化关系
B. NaHX溶液显碱性
C. 当混合溶液呈中性时,![]()
D. ![]() 的数量级为
的数量级为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com