
����Ŀ����֪Ca3(PO4)2��SiO2��C���¹��ȿ��Է�Ӧ�õ�CaSiO3��P4������CO����Ӧ���£�Ca3(PO4)2+SiO2+C![]() CaSiO3+P4��+CO����
CaSiO3+P4��+CO����
��1����ƽ�÷�Ӧ����ʽ�����������ת�Ʒ������Ŀ_____��
��2���÷�Ӧ�б���ԭ��Ԫ����___������������______��
��3��ÿ����24.0g̼ʱ����___�����ӷ���ת�ƣ�����P4__g��
��4����Ӧ���û�����壬����ɱ���£��������ܶ�Ϊ____g/L��������λС������
��5����÷�Ӧ���漰������Ԫ����ͬ����ĵ�Ԫ�أ������ˮ�帻Ӫ��������Ҫԭ����ij��ˮ��NH4Cl����Ϊ180 mg/L��
��д��NH4Cl�ĵ���ʽ____��
��Ϊ��ȥ��ˮ�е�NH4+����103L����ˮ�м���0.1 mol/LNaOH��Һ���������·�Ӧ��NH4++OH-=NH3+H2O������������ҪNaOH��Һ�����Ϊ___L��������������λС������
���𰸡�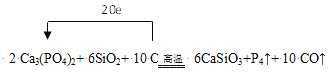
![]() CO 4NA 24.8 1.64
CO 4NA 24.8 1.64 ![]() 33.64
33.64
��������
��1�����û��ϼ���������ƽ��
��2����Ӧ������������ԭ�����ϼ۽��ͣ���ԭ�������������������
��3������������ԭ��Ӧ�е�ʧ�����غ���㣻
��4������![]() =m/V���㣻
=m/V���㣻
��5����NH4ClΪ���ӻ������笠����ӡ������ӹ��ɣ�
�ڸ��ݷ���ʽ���㡣
��1����Ӧ��C�Ļ��ϼ���0�۱�Ϊ+2�ۣ�P�Ļ��ϼ���+5��Ϊ0�ۣ�����P4��������4��P���뷴Ӧ������С������Ϊ20��ת��20�����ӣ���Ca3(PO4)2��ϵ��Ϊ2��P4ϵ��Ϊ1��C��CO��ϵ��Ϊ10������ԭ���غ㣬SiO2ϵ��Ϊ6������ʽ������ת�Ʒ���Ϊ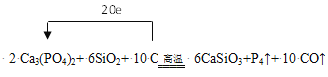 ��
��
��2����Ӧ������������ԭ�����ϼ۽��ͣ���ԭ��Ԫ��Ϊ![]() ����ԭ�������������������ΪCO��
����ԭ�������������������ΪCO��
��3��ÿ����24.0g̼ʱ����2mol��ת��4mol���ӣ�����0.2mol P4����24.8g��
��4��ÿ����24.0g̼ʱ������2molCO��0.2mol P4��������������Ϊ56+24.8=80.8g������µ����Ϊ2.2![]() 22.4=49.28L���ܶ�=80.8g/49.28L=1.64g/L��
22.4=49.28L���ܶ�=80.8g/49.28L=1.64g/L��
��5����NH4ClΪ���ӻ������笠����ӡ������ӹ��ɣ������ʽΪ![]() ��
��
��180 mg/L![]() 103L=180g��n��NH4Cl��=180g/53.5g/mol=3.364mol�����ݷ���ʽ��n��NH4Cl��= n��NaOH��=0.1 mol/L
103L=180g��n��NH4Cl��=180g/53.5g/mol=3.364mol�����ݷ���ʽ��n��NH4Cl��= n��NaOH��=0.1 mol/L![]() V����V=33.64L��
V����V=33.64L��


 ���ɶ��ȫ���ƿؾ�ϵ�д�
���ɶ��ȫ���ƿؾ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E��FΪ��ѧ��ѧ�����ĵ��ʻ������A��FΪ���ʣ������£�E��Ũ��Һ��ʹ�������ۻ����ת����ϵ��ͼ��ʾ����������ȥ��������������⣺
��1����AΪ����ɫ���壬BΪ���壬FΪ�ǽ������ʡ�
��д��Eת��ΪC�Ļ�ѧ����ʽ_____��
��B�ڿ�������ʹ��������ʧȥ����������ڣ���Ӧ�Ļ�ѧ����ʽΪ_____��
��2����BΪ��ʹʪ��ĺ�ɫʯ����ֽ���������塣
��A�ĵ���ʽΪ_____��
������������Ӧ����Թܿ���E��ϡ��Һ��ϴ����Ӧ�����ӷ���ʽΪ_____��
���ڸ���״̬�£���ڷ�Ӧ�õ���������ͨ�������������õ�N2O5��һ�����嵥�ʣ�д����Ӧ�Ļ�ѧ����ʽ_____��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧС���о���������������ʱ���ı��ܱ�������ijһ������A2(g)��3B2(g)![]() 2AB3(g) ��ѧƽ��״̬��Ӱ�죬�õ�����ͼ��ʾ������(ͼ��T��ʾ�¶ȣ�n��ʾ���ʵ���)�������ж���ȷ����( )
2AB3(g) ��ѧƽ��״̬��Ӱ�죬�õ�����ͼ��ʾ������(ͼ��T��ʾ�¶ȣ�n��ʾ���ʵ���)�������ж���ȷ����( )

A. ��T2��n(A2)����ʱ�ﵽƽ�⣬AB3�����ʵ�����С Ϊ��c>b>a
B. ��T2>T1��������Ӧһ���Ƿ��ȷ�Ӧ
C. �ﵽƽ��ʱA2��ת���ʴ�СΪ��b>a>c
D. ��T2>T1���ﵽƽ��ʱb��d��ķ�Ӧ����Ϊvd>vb
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ϡ��ˮ�д���������ƽ�⣺NH3��H2O![]() NH4+��OH������Ҫʹƽ�����淴Ӧ�����ƶ���ͬʱʹc(OH��)����Ӧ��������ʻ��ȡ�Ĵ�ʩ��
NH4+��OH������Ҫʹƽ�����淴Ӧ�����ƶ���ͬʱʹc(OH��)����Ӧ��������ʻ��ȡ�Ĵ�ʩ��
��NH4Cl���壻�������NaOH���壻��ˮ�������ȣ�����������MgSO4���塣
A. �٢ڢۢ� B. �ۢ� C. �� D. �ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״���������ǿ����Һ������ʵ��ֻ�����еķ�ӦΪ2CH3OH+3O2��40H-![]() 2CO32-+6H2O���й�˵����ȷ����
2CO32-+6H2O���й�˵����ȷ����
A. �ŵ�ʱ��CH3OH ���뷴Ӧ�ĵ缫Ϊ����
B. �ŵ�ʱ�������缫��Ӧ��CH3OH+8OH--6e-=CO32-+6H2O
C. ��״���£�ͨ���11.2LO2��ȫ��Ӧ��1mol����ת��
D. ���ʱ�������Һ��pH��С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��25��ʱ��N2��H2��Ӧ�����������仯������ͼ������������ȷ����
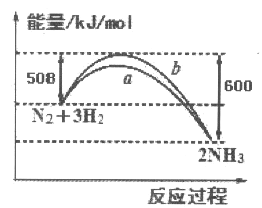
A. �÷�ӦΪ���ȷ�Ӧ
B. b�����DZ�ʾ�����˴���ʱ�������仯����
C. ��������������˷�Ӧ����ЧӦ
D. ��Ӧ��ʼͨ��1 mol N2��3 mol H2����Ӧ��ų�������һ��Ϊ92kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Z�Ǻϳ�ƽ��ҩɳ���������м��壬��ͨ������·���Ƶã�

����˵����ȷ����
A. 1 mol Z�������2 mol NaOH��Ӧ
B. Y���Է���ȡ����Ӧ��������Ӧ����ȥ��Ӧ
C. ����FeCl3��Һ����Y��Z
D. X����������ԭ����ͬһƽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����û�ѧ��Ӧԭ���о�̼��������ĵ��ʼ��仯����ķ�Ӧ�Ի������Ⱦ����ԴΣ��������Ҫ���塣
I��CO ��ԭNO ��������Ӧ��2CO(g)��2NO(g) 2CO2(g)��N2(g) ��H
��1����֪��CO(g)��NO2(g) CO2(g)��NO(g) ��H1=��226 kJ��mol-1
N2(g)��2O2(g) 2NO2(g) ��H2=��68 kJ��mol-1
N2(g)��O2(g) 2NO(g) ��H3=��183 kJ��mol-1
������Ӧ��H=__________�����������NO ƽ��ת���ʵ�������________________��д����������
��2������ʹ���Ҵ����Ͳ����ܼ���NOx���ŷţ���ʹNOx����Ч������Ϊ�����������Ҫ���⡣ij�о�С����ʵ������Ag-ZSM-5Ϊ��������CO��NO��ת�������о������NOת��ΪN2��ת�������¶ȡ�CO������ı仯�������ͼ��ʾ��

������ʹ��CO���¶ȳ���775��������NO�ķֽ��ʽ��ͣ�����ܵ�ԭ��Ϊ_________________����n(NO)/n(CO)��1�������£�Ӧ��������¶���____________���ҡ�
����CxHy(��)����ԭNOxҲ�����������������Ⱦ��д��C2H6��NO2������Ӧ�Ļ�ѧ����ʽ��_________��
��NO2β������NaOH��Һ���գ�����NaNO3��NaNO2����֪NO2����ˮ�ⳣ��K=2��10-11��������ijNaNO2��HNO2�����Һ��pHΪ5��������Һ��c(NO2��)��c(HNO2)�ı�ֵΪ__________��
II��T ��ʱ���ڸ��Է�Ӧ���з������·�Ӧ��CO(g)��NO2(g) CO2(g)��NO(g)����ѧ��Ӧ����v =k Pm(CO)Pn(NO2)��k Ϊ��ѧ��Ӧ���ʳ������о����������¶��·�Ӧ��ķ�ѹ�뻯ѧ��Ӧ���ʵĹ�ϵ���±���ʾ��

��3������Ӧ��ʼʱP(CO)=P(NO2)=a kPa����Ӧt minʱ�ﵽƽ�⣬�����ϵ��P(NO)=b kPa�����ʱv =___________ kPa��s-1���ú���a��b�Ĵ���ʽ��ʾ����ͬ�����÷�Ӧ�Ļ�ѧƽ�ⳣ��Kp=_____��Kp���Է�ѹ��ʾ��ƽ�ⳣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪʵ����ijŨ�����Լ�ƿ�ϵı�ǩ���й����ݣ��Ը��ݱ�ǩ�ϵ��й����ݻش��������⣺

��1����Ũ������HCl�����ʵ���Ũ��Ϊ_______molL��1��
��2��ȡ����������ĸ�����ʱ�������������в�����ȡ����Ķ��ٶ��仯����______������ĸ����
A����Һ��HCl�����ʵ��� B����Һ��Ũ��
C����Һ��Cl������Ŀ D����Һ���ܶ�
��3��ijѧ����������Ũ���������ˮ����500 mL���ʵ���Ũ��Ϊ0.400 mol��L-1��ϡ���ᡣ
�ٸ�ѧ����Ҫ��ȡ________mL����Ũ����������ơ�
�������ƹ����У�����ʵ������������Ƶ�ϡ��������ʵ���Ũ���к�Ӱ�죿������������A��ʾ��ƫ��������B��ʾ��ƫС������C��ʾ����Ӱ��������
I������Ͳ��ȡŨ����ʱ���ӹ۲찼Һ��________��
II��ת��Ũ��Һʱ������������һ��Һ�彦������ƿ________��
III������ҡ�Ⱥ���Һ����ڿ̶���________��
IV������ʱ�����Ӷ�����������Һ��Ũ��________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com