
【题目】常温下,将NaOH溶液滴入二元弱酸H2X溶液中,混合溶液中的粒子浓度与溶液pH的变化关系如下图所示。下列叙述正确的是( )

A. 曲线M表示![]() 与pH的变化关系
与pH的变化关系
B. NaHX溶液显碱性
C. 当混合溶液呈中性时,![]()
D. ![]() 的数量级为
的数量级为![]()
【答案】C
【解析】
H2X为二元弱酸,以第一步电离为主,则Ka1(H2X)>Ka2(H2X),酸性条件下,则pH相同时![]() >
> ![]() ,由图象可知N为lg
,由图象可知N为lg![]() 的变化曲线,M为lg
的变化曲线,M为lg![]() 的变化曲线,当lg
的变化曲线,当lg![]() 或lg
或lg![]() = 0时,说明
= 0时,说明![]() 或
或 ![]() =1,浓度相等,结合图象可计算电离常数的表达式并判断溶液的酸碱性。
=1,浓度相等,结合图象可计算电离常数的表达式并判断溶液的酸碱性。
A. 由以上分析可知曲线N表示pH与lg![]() 的变化关系,曲线M表示pH与lg
的变化关系,曲线M表示pH与lg![]() 的变化曲线,故A项错误;
的变化曲线,故A项错误;
B. 由图象可知,lg![]() = 0时,即
= 0时,即![]() =1,此时pH≈5.4,可知HX电离程度大于X2水解程度,则NaHX溶液呈酸性,故B项错误;
=1,此时pH≈5.4,可知HX电离程度大于X2水解程度,则NaHX溶液呈酸性,故B项错误;
C. 由图象可知当混合溶液呈中性时,lg![]() > 0,即c(X2)>c(HX),混合溶液的离子浓度大小关系为:c(Na+)>c(X2-)> c(HX-)> c(H+)=c(OH),故C项正确。
> 0,即c(X2)>c(HX),混合溶液的离子浓度大小关系为:c(Na+)>c(X2-)> c(HX-)> c(H+)=c(OH),故C项正确。
D. lg![]() = 0时,
= 0时,![]() =1,此时pH≈5.4,则Ka2(H2X)≈105.4,可知Ka2(H2X)的数量级为10-6,故D项错误;
=1,此时pH≈5.4,则Ka2(H2X)≈105.4,可知Ka2(H2X)的数量级为10-6,故D项错误;
答案选C。


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:
【题目】化合物Z是合成平喘药沙丁胺醇的中间体,可通过下列路线制得:

下列说法正确的是
A. 1 mol Z最多能与2 mol NaOH反应
B. Y可以发生取代反应、氧化反应、消去反应
C. 可用FeCl3溶液鉴别Y和Z
D. X分子中所有原子在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种从铜电解工艺的阳极泥中提取Se和Te的流程如下:
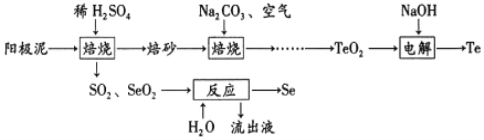
下列叙述错误的是( )
A. 合理处理阳极泥有利于保护环境和资源再利用
B. 流出液是H2SO4溶液
C. 电解过程中阴极上析出单质Te
D. “焙砂”与碳酸钠充分混合后,可在瓷坩锅中焙烧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室某浓盐酸试剂瓶上的标签的有关内容,试根据标签上的有关数据回答下列问题:

(1)该浓盐酸中HCl的物质的量浓度为_______molL﹣1。
(2)取用任意体积的该盐酸时,下列物理量中不随所取体积的多少而变化的是______(填字母)。
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl﹣的数目 D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制500 mL物质的量浓度为0.400 mol·L-1的稀盐酸。
①该学生需要量取________mL上述浓盐酸进行配制。
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(在括号内填A表示“偏大”、填B表示“偏小”,填C表示“无影响”)。
I.用量筒量取浓盐酸时俯视观察凹液面________;
II.转移浓溶液时操作不慎,有一滴液体溅出容量瓶________;
III.定容摇匀后,发现液面低于刻度线________;
IV.定容时,俯视读数,所得溶液的浓度________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为探究浅黄色液体X(仅含三种常见元素)的组成和性质,设计并完成如下实验:
 请回答如下问题:
请回答如下问题:
(1)X的化学式是_________。
(2)X在过量氧气中燃烧的化学方程式是_________。
(3)溶液C滴在淀粉KI试纸上,试纸显蓝色,写出该变化中发生的离子方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000mol/L的NaOH溶液滴定20ml同浓度的一元弱酸HA,滴定过程溶液pH随X的变化曲线如图所示(忽略中和热效应),下列说法不正确的是

A. HA溶液加水稀释后,溶液中c(HA)/c(A-)的值减小
B. HA的电离常数KHA=10-7x/(100-x)(x为滴定分数)
C. 当滴定分数为100时,溶液中水的电离程度最大
D. 滴定分数大于100时,溶液中离子浓度关系是c(Na+)>c(A-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列氧化还原反应中,水作为氧化剂的是( )
A. CO+H2O![]() CO2+H2B. CuO+H2
CO2+H2B. CuO+H2![]() Cu+H2O
Cu+H2O
C. 2F2+2H2O═4HF+O2D. 3NO2+H2O═2HNO3+NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以高氯冶炼烟灰(主要成分为铜锌的氯化物、氧化物、硫酸盐,少量铁元素和砷元素)为原料,可回收制备Cu和ZnSO4H2O,其主要实验流程如下:
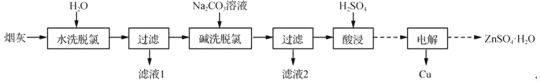
已知:①Fe3+完全沉淀pH为3.2,此时Zn2+、Cu2+未开始沉淀;
②K3[Fe(CN)6]可用于检验Fe2+:3Fe2++2[Fe(CN)6]3﹣═Fe3[Fe(CN)6]2↓(深蓝色);
③砷元素进入水体中对环境污染大,可通过沉淀法除去。
(1)两段脱氯均需在85℃条件下进行,适宜的加热方式为_____。
(2)碱洗脱氯时,溶液中Cu2+主要转化为Cu(OH)2和Cu2(OH)2CO3,也会发生副反应得到Cu2(OH)3Cl沉淀并放出气体,该副反应的离子方程式为_____。若用NaOH溶液进行碱洗操作时,浓度不宜过大,通过下表的数据分析其原因是_____。
NaOH溶液浓度对脱氯率和其他元素浸出率的影响
NaOH浓度/molL﹣1 | 脱氯率/% | 元素浸出率/% | ||
Cl | Zn | Cu | As | |
1.0 | 51.20 | 0.51 | 0.04 | 0.00 |
2.0 | 80.25 | 0.89 | 0.06 | 58.87 |
3.0 | 86.58 | 7.39 | 0.26 | 78.22 |
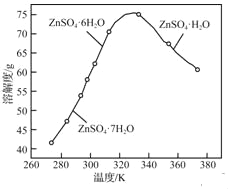
(3)ZnSO4的溶解度曲线如下图所示。“电解”后,从溶液中回收ZnSO4H2O的实验、操作为_____。
(4)滤液1和滤液2中含一定量的Cu2+、Zn2+.为提高原料利用率,可采取的措施有:将滤液1和滤液2混合,回收铜锌沉淀物;循环使用电解过程产生的_____(填化学式)。
(5)已知H3AsO3的还原性强于Fe2+,Ksp(FeAsO3)>Ksp(FeAsO4)=5.7×10﹣21.测得酸浸液中杂质铁元素(以Fe2+存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肯定属于同族元素且性质相似的是
A. A原子基态时2p轨道上有一对成对电子,B原子基态时3p轨道上也有一对成对电子
B. 结构示意图:A为 ![]() ,B为
,B为![]()
C. A原子基态时2p轨道有1个未成对电子,B原子基态时3p轨道也有1个未成对电子
D. 原子核外电子排布式:A为1s22s2,B为1s2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com