
【题目】以高氯冶炼烟灰(主要成分为铜锌的氯化物、氧化物、硫酸盐,少量铁元素和砷元素)为原料,可回收制备Cu和ZnSO4H2O,其主要实验流程如下:
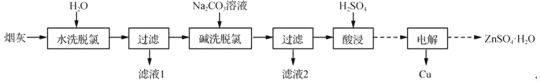
已知:①Fe3+完全沉淀pH为3.2,此时Zn2+、Cu2+未开始沉淀;
②K3[Fe(CN)6]可用于检验Fe2+:3Fe2++2[Fe(CN)6]3﹣═Fe3[Fe(CN)6]2↓(深蓝色);
③砷元素进入水体中对环境污染大,可通过沉淀法除去。
(1)两段脱氯均需在85℃条件下进行,适宜的加热方式为_____。
(2)碱洗脱氯时,溶液中Cu2+主要转化为Cu(OH)2和Cu2(OH)2CO3,也会发生副反应得到Cu2(OH)3Cl沉淀并放出气体,该副反应的离子方程式为_____。若用NaOH溶液进行碱洗操作时,浓度不宜过大,通过下表的数据分析其原因是_____。
NaOH溶液浓度对脱氯率和其他元素浸出率的影响
NaOH浓度/molL﹣1 | 脱氯率/% | 元素浸出率/% | ||
Cl | Zn | Cu | As | |
1.0 | 51.20 | 0.51 | 0.04 | 0.00 |
2.0 | 80.25 | 0.89 | 0.06 | 58.87 |
3.0 | 86.58 | 7.39 | 0.26 | 78.22 |
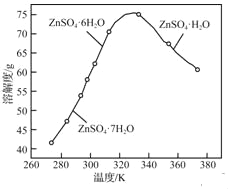
(3)ZnSO4的溶解度曲线如下图所示。“电解”后,从溶液中回收ZnSO4H2O的实验、操作为_____。
(4)滤液1和滤液2中含一定量的Cu2+、Zn2+.为提高原料利用率,可采取的措施有:将滤液1和滤液2混合,回收铜锌沉淀物;循环使用电解过程产生的_____(填化学式)。
(5)已知H3AsO3的还原性强于Fe2+,Ksp(FeAsO3)>Ksp(FeAsO4)=5.7×10﹣21.测得酸浸液中杂质铁元素(以Fe2+存在
【答案】水浴加热(或85℃水浴加热) 4Cu2++3CO32﹣+2Cl﹣+3H2O=2Cu2(OH)3Cl↓+3CO2↑; NaOH浓度高时Zn元素损失较多,As元素浸出率高,增加废水处理难度; 在330K以上(330~380K)蒸发结晶,趁热过滤,热水洗涤干燥; H2SO4 向酸浸滤液中加入过量30%双氧水,搅拌使其充分反应,取样滴加0.001molL﹣1K3[Fe(CN)6]溶液无深蓝色沉淀,加入回收的铜锌沉淀物并搅拌至调节pH为3.2,静置,过滤,取滤液。
【解析】
将水加入高氯冶炼烟灰(主要成分为铜锌的氯化物、氧化物、硫酸盐,少量铁元素和砷元素),溶解可溶性氯化物,过滤得到不溶物,将碳酸钠溶液加入不溶物,脱氯,锌铜沉淀,过滤得到相应沉淀物,再加入稀硫酸溶解,得到铜离子、锌离子的溶液,电解得到铜单质和硫酸锌溶液,再经过蒸发结晶,趁热过滤,热水洗涤干燥得到ZnSO4H2O,
(1)两段脱氯均需在85℃条件下进行,选用水浴加热;
(2)溶液中Cu2+与碳酸根离子、氯离子结合得到Cu2(OH)3Cl和二氧化碳;分析图表,若用NaOH溶液进行碱洗操作时,考虑减少Zn的损失,减少As的浸出率;
(3)分析图表330~380K范围内从溶液中回收ZnSO4H2O;
(4)通过流程可知H2SO4可循环使用;
(5)已知H3AsO3的还原性强于Fe2+,Ksp(FeAsO3)>Ksp(FeAsO4)=5.7×10﹣21,测得酸浸液中杂质铁元素(以Fe2+存在)、砷元素(以H3AsO3存在),应先将Fe2+氧化为Fe3+,FeAsO3氧化为FeAsO4,再调节pH除去铁元素和砷元素,据此分析。
(1)两段脱氯均需在85℃条件下进行,温度要求在100℃以下,选用水浴加热即可;
故答案为:水浴加热(或85℃水浴加热);
(2)碱洗脱氯时,溶液中Cu2+与CO32﹣、Cl﹣发生副反应得到Cu2(OH)3Cl沉淀并放出CO2气体,离子方程式为:4Cu2++3CO32﹣+2Cl﹣+3H2O=2Cu2(OH)3Cl↓+3CO2↑;根据图表,若用NaOH溶液进行碱洗操作时,随着NaOH浓度的增大,Zn元素浸出率增大,损失增多,As元素浸出率高,会增加废水处理难度,故NaOH浓度不宜过大;
故答案为:4Cu2++3CO32﹣+2Cl﹣+3H2O=2Cu2(OH)3Cl↓+3CO2↑;NaOH浓度高时Zn元素损失较多,As元素浸出率高,增加废水处理难度;
(3)根据ZnSO4的溶解度曲线,“电解”后,从溶液中回收ZnSO4H2O的实验、操作为:在330K以上(330~380K)蒸发结晶,趁热过滤,热水洗涤干燥;
故答案为:在330K以上(330~380K)蒸发结晶,趁热过滤,热水洗涤干燥;
(4)由流程可知,加入的有H2SO4,电解时,阴极得到铜单质,阳极氢氧根放电,电解得到H2SO4,可以循环使用;
故答案为:H2SO4;
(5)已知H3AsO3的还原性强于Fe2+,Ksp(FeAsO3)>Ksp(FeAsO4)=5.7×10﹣21,测得酸浸液中杂质铁元素(以Fe2+存在)、砷元素(以H3AsO3存在),应先将Fe2+氧化为Fe3+,用K3[Fe(CN)6]溶液检验是否氧化完全,FeAsO3氧化为FeAsO4,再调节pH除去铁元素和砷元素,故实验方案为:向酸浸滤液中加入过量30%双氧水,搅拌使其充分反应,取样滴加0.001molL﹣1K3[Fe(CN)6]溶液无深蓝色沉淀,加入回收的铜锌沉淀物并搅拌至调节pH为3.2,静置,过滤,取滤液;
故答案为:向酸浸滤液中加入过量30%双氧水,搅拌使其充分反应,取样滴加0.001molL﹣1K3[Fe(CN)6]溶液无深蓝色沉淀,加入回收的铜锌沉淀物并搅拌至调节pH为3.2,静置,过滤,取滤液。


科目:高中化学 来源: 题型:
【题目】锌锰干电池的负极是作为电池壳体的金属锌,正极是被二氧化锰和碳粉包围的石墨电极,电解质是氯化锌和氯化铵的糊状物,该电池放电过程中产生 MnOOH。废旧电池中的Zn、Mn元素的回收,对环境保护有重要的意义。
Ⅰ. 回收锌元素,制备ZnCl2
步骤一:向除去壳体及石墨电极的黑色糊状物中加水,搅拌,充分溶解,经过滤分离得固体和滤液。
步骤二:处理滤液,得到ZnCl2·xH2O晶体。
步骤三:将SOCl2与ZnCl2·xH2O晶体混合制取无水ZnCl2。
制取无水ZnCl2,回收剩余的SOCl2并验证生成物中含有SO2(夹持及加热装置略) 的装置如下:

(已知: SOCl2是一种常用的脱水剂,熔点-105℃,沸点79℃,140℃以上时易分解,与水剧烈水解生成两种气体。)
(1)写出SOCl2与水反应的化学方程式:______________________。
(2)接口的连接顺序为a→___→___→ h → h →___→___→___→e。______________
Ⅱ. 回收锰元素,制备MnO2
(3)洗涤步骤一得到的固体,判断固体洗涤干净的方法:_________________________。
(4)洗涤后的固体经初步蒸干后进行灼烧,灼烧的目的__________________________。
Ⅲ. 二氧化锰纯度的测定
称取1.40g灼烧后的产品,加入2.68g草酸钠(Na2C2O4)固体,再加入足量的稀硫酸并加热(杂质不参与反应),充分反应后冷却,将所得溶液转移到100mL容量瓶中用蒸馏水稀释至刻线,从中取出20.00mL,用0.0200mol/L高锰酸钾溶液进行滴定,滴定三次,消耗高锰酸钾溶液体积的平均值为17.30mL。
(5)写出MnO2溶解反应的离子方程__________________________________________。
(6)产品的纯度为______________________ 。
(7)若灼烧不充分,滴定时消耗高锰酸钾溶液体积_____(填“偏大”、“ 偏小”、“ 不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将NaOH溶液滴入二元弱酸H2X溶液中,混合溶液中的粒子浓度与溶液pH的变化关系如下图所示。下列叙述正确的是( )

A. 曲线M表示![]() 与pH的变化关系
与pH的变化关系
B. NaHX溶液显碱性
C. 当混合溶液呈中性时,![]()
D. ![]() 的数量级为
的数量级为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟化钡可用于制造电机电刷、光学玻璃、光导纤维、激光发生器。以钡矿粉(主要成分为BaCO3,含有SiO2、Fe2+、Mg2+等杂质)制备氟化钡的流程如下:
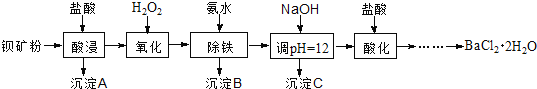
已知:常温下Fe3+、Mg2+完全沉淀的pH分别是:3.4、12.4。
(1)滤渣A的名称为___________。
(2)滤液1加H2O2的目的是___________。
(3)加NaOH溶液调节pH=12.5,得到滤渣C的主要成分是___________(写化学式)
(4)滤液3加入盐酸酸化后再经加热浓缩____________洗涤,真空干燥等一系列操作后得到BaCl2·2H2O晶体。
(5)常温下,用BaCl2·2H2O配制成0.2 mol/L水溶液与氟化铵溶液反应,可得到氟化钡沉淀。请写出该反应的离子方程式___________。已知Ksp(BaF2)=1.84×10-7,当钡离子完全沉淀时(即钡离子浓度≤10-5 mol/L),至少需要的氟离子浓度是___________mol/L(已知![]() =1.36,计算结果保留三位有效数字)。
=1.36,计算结果保留三位有效数字)。
(6)5.0 t含80%BaCO3的钡矿粉,理论上最多能生成BaCl2·2H2O晶体___________t 。(保留2位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中A~H均为中学化学中常见的物质,A、B、H为气体,反应①是重要的工业反应,它们之间有如下转化关系(反应中生成的水已略去)。

请回答以下问题:
(1)B是_____,D是_____,G是_____,H是_____(填化学式)。
(2)工业上常利用反应①制取漂白粉,该反应的化学方程式:__________,漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为_________。
(3)A中元素的原子结构示意图为________。
(4)F在溶液中的电离方程式为_________。
(5)上述反应中属于氧化还原反应的是_______(填写序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2(l)在有MnO2条件下和无MnO2条件下分解的能量变化如图所示。下列说法正确是

A. 有MnO2条件下的反应曲线是a曲线
B. a曲线变为b曲线,反应的活化分子百分数增大
C. a曲线变为b曲线,平衡时H2O2的转化率增大
D. b曲线的热化学方程式为:H2O2(l) =H2O(l) +1/2O2(g) ΔH= - ( E1 - E2)KJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】填空题。
(1)47.5g某二价金属的氯化物中含有1molCl-,则该金属氯化物的摩尔质量为_______ ;该金属的相对原子质量为_______ 。
(2)标准状况下,3.4g NH3 的体积为_______ ;它与标准状况下_______ L H2S含有相同数目的氢原子。
(3)已知CO、CO2混合气体的质量共10.0g,在标准状况下的体积为6.72L,则混合气体中CO的质量为_______ ;CO2在相同状况下的体积为_______ 。
(4)将4g NaOH 溶解在10mL水中,再稀释成1L,从中取出10mL,这10mL溶液的物质 的量浓度为_______。
(5)已知ag氢气中含有b个氢原子,则阿伏加德罗常数的值可表示为 _______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设nA为阿伏伽德罗常数的数值,下列说法正确的是
A. 23g Na 与足量H2O反应完全后可生成nA个H2分子
B. 1 molCu和足量热浓硫酸反应可生成nA个SO3分子
C. 标准状况下,22.4L N2和H2混合气中含nA个原子
D. 3mol单质Fe完全转变为Fe3O4,失去8nA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素的单质和常见的化合物在工、农业生产中用途广泛.
(1)工业上利用分离空气的方法得到氮气.空气各主要成分的沸点如下:
N2 | O2 | Ar | CO2 |
-196℃ | -183℃ | -186℃ | -78℃ |
现将空气深度冷却液化,然后缓慢升温,则最先分离出来的气体是____________;
(2)雷雨时空气中的N2转化为NO,生成物NO是______色的气体,________(填“易”或“难”)溶于水;NO在空气中很容易被氧化成NO2,NO2能与水发生化学反应. NO2与水反应的化学方程式为_______________________________;
(3)实验室可用固体NH4Cl与固体Ca(OH)2加热反应制取氨气.
①制取氨气的化学方程式为_____________________________;
②要制取标准状况下4.48L的氨气,至少需要称取固体NH4Cl的质量为______g;
(4)已知:4NH3+6NO![]() 5N2+6H2O化学研究性学习小组的同学在技术人员的指导下,按下列流程,探究不同催化剂对NH3还原NO反应的催化性能.
5N2+6H2O化学研究性学习小组的同学在技术人员的指导下,按下列流程,探究不同催化剂对NH3还原NO反应的催化性能.
![]()
将经催化反应后的混合气体,通过一定体积滴有酚酞的稀硫酸溶液.NH3与稀硫酸溶液反应的化学方程式为____________________________________________;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com