
【题目】已知:常温下浓度均为0.1 mol·L-1的下列各溶液的pH如下表所示,下列有关说法正确的是( )
溶质 | NaF | NaClO | Na2CO3 |
pH | 7.5 | 9.7 | 11.6 |
A. 在相同温度下,同浓度的三种酸溶液的导电能力顺序:H2CO3<HClO<HF
B. 若将CO2通入0.1 mol·L-1 Na2CO3溶液中至溶液呈中性,则溶液中2c(CO32-)+c(HCO3-)=0.1 mol·L-1(忽略溶液体积变化)
C. 根据上表,水解方程式ClO-+H2O![]() HClO+OH-的平衡常数K≈10-7.6
HClO+OH-的平衡常数K≈10-7.6
D. 向上述NaClO溶液中通过量CO2气体的离子方程式为:2ClO-+CO2+H2O === 2HClO+CO32-
【答案】C
【解析】
根据同浓度弱酸盐溶液的pH,比较弱酸阴离子水解能力、对应弱酸的电离能力,进而判断反应能否进行,计算水解常数等。
A项:0.1 mol·L-1溶液的pH:NaF<NaClO<Na2CO3,则水解能力:F-<ClO-<CO32-,对应弱酸电离能力(酸性):HF>HClO>HCO3-。又酸性H2CO3>HCO3-(A项错误)。
B项:CO2通入0.1 mol·L-1 Na2CO3溶液后,符合电荷守恒2c(CO32-)+c(HCO3-)+c(OH-)=c(Na+)+c(H+),其中c(Na+)=0.2 mol·L-1。溶液呈中性时c(OH-)=c(H+),得2c(CO32-)+c(HCO3-)=0.2 mol·L-1,B项错误;
C项:0.1 mol·L-1NaClO溶液pH=9.7,则c(H+)=10-9.7mol·L-1,c(OH-)=10-4.3mol·L-1。c(ClO-)≈10-4.3mol·L-1,c(HClO)≈0.1mol·L-1,则水解平衡常数K≈10-7.6,C项正确;
D项:CO2气体过量时生成NaHCO3,离子方程式为ClO-+CO2+H2O=HClO+HCO3-。D项错误。
本题选C。


科目:高中化学 来源: 题型:
【题目】下列内容与结论相对应的是
选项 | 内容 | 结论 |
A | H2O(g)变成H2O(l) | △S>0 |
B | 硝酸铵溶于水可自发进行 | 因为△S>0 |
C | 一个反应的△H>0,△S>0 | 反应一定不自发进行 |
D | H2(g)+F2(g)=2HF(g),△H=-271kJ/mol △S=8J/(mol·K) | 反应在任意外界条件下均可自发进行 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,对于可逆反应X(g)+3Y(g)![]() 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达平衡时,X、Y、Z的浓度分别为0.1 mol/L、0.3 mol/L、0.08 mol/L,则下列判断正确的是 ( )
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达平衡时,X、Y、Z的浓度分别为0.1 mol/L、0.3 mol/L、0.08 mol/L,则下列判断正确的是 ( )
A. c1:c2=3∶1 B. 平衡时,Y和Z的生成速率之比为2∶3
C. X、Y的转化率不相等 D. c1的取值范围为0 mol/L<c1 <0.14 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙烯是生产塑料和合成橡胶的重要基本有机原料,乙苯催化脱氢法是目前国内外生产苯乙烯的主要方法,其化学方程式为:
![]()
(1)若升高温度,该反应的平衡常数变大,则ΔH_______0(填“大于”或“小于”)。该反应在_______________条件下能自发进行。
(2)维持体系总压强ρ恒定,在温度T时,物质的量为2mol、体积为1L的乙苯蒸汽发生催化脱氢反应。已知乙苯的平衡转化率为80%,则在该温度下反应的平衡常数K=_____。
(3)在体积为2L的恒温密闭容器中通入2mol乙苯蒸汽,2分钟后达到平衡,测得氢气的浓度是0.5mol/L,则乙苯蒸汽的反应速率为_________________;维持温度和容器体积不变,向上述平衡中再通入1mol氢气和1mol乙苯蒸汽,则v正_______v逆(填“大于”、“小于”或“等于”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近科学家利用下列装置图成功地实现了CO2和H2O合成CH4。下列叙述错误的是( )
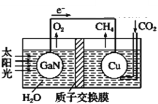
A. 电池工作时,实现了将太阳能转化为电能
B. 铜电极为正极,电极反应式为CO2+4e-+8H+=CH4+2H2O
C. 电池内 H+ 透过质子交换膜从左向右移动
D. 为提高该人工光合系统的工作效率,可向装置中加入少量稀硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】储氢纳米碳管的研究成功体现了科技的进步,但用电弧法合成的碳纳米管常伴有大量的杂质——碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯其反应式为C+K2Cr2O7+H2SO4=CO2+K2SO4+Cr2(SO4)3+H2O(未配平)
(1)配平上述方程式__C+__K2Cr2O7+__H2SO4=__CO2+ __K2SO4+__Cr2(SO4)3+__H2O
(2)上述反应中氧化剂是_______(填化学式),氧化产物是__________(填化学式)
(3)H2SO4在上述发应中表现出来的性质是_______(填序号)
a.氧化性 b.氧化性和酸性 c.酸性 d.还原性和酸性
(4)若反应中电子转移了0.8mol,则产生的气体在标准状况下的体积为__________ L
(5)要使10mL0.5mol/L的K2Cr2O7,溶液被还原,至少要加入 ________ mL2mol/L的H2SO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是不同温度下水的离子积常数,试回答以下问题:
温度(℃) | 25 | t1 | t2 |
水的离子积常数 | 1×10-14 | α | 1×10-12 |
(1)若25<t1<t2,则α______(填“<”“>”或“=”)1×10-14。
(2)25℃下,某Na2SO4溶液中c(SO42-)=5×10-4mol·L-1,取该溶液1mL,加水稀释至10mL,则稀释后溶液中c(Na+):c(OH-)=________。
(3)25℃下,将pH=1的盐酸溶液和pH=5的盐酸溶液等体积混合,则混合液中水电离出的c(OH-)=________。
(4)将t2℃温度下pH=11的苛性钠溶液a L与pH=1的稀硫酸溶液bL混合,所得混合溶液pH=2,则a:b=______;此溶液中离子浓度的由大到小的排列顺序是______________________________。(以上均忽略溶液混合前后体积的变化)
(5)将t2℃温度下pH=9的苛性钠溶液与pH=y的稀醋酸溶液等体积混合,所得混合溶液显中性,则y____3(填“大于”“小于”或“等于”);此溶液中微粒浓度的由大到小的排列顺序是________________________。(以上均忽略溶液混合前后体积的变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如下图所示(部分物质与条件已略去)。A、B、C、D、F均为气体,其中A的相对分子质量为16,F是黄绿色单质;E是最常见的液体;X微溶于水,反应①是工业生产中的重要反应,反应②常用于D的检验。

请回答下列问题:
(1)A的电子式为______。
(2)C的化学式为______。
(3)写出反应①的化学方程式:________________。
(4)写出反应②的离子方程式:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池结构如图所示,下列有关该原电池的说法不正确的是( )
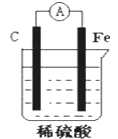
A. 能将化学能转换成电能
B. 电子从碳棒经外电路流向铁棒
C. 碳棒发生还原反应
D. 总反应为Fe+H2SO4= FeSO4+H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com