
【题目】某原电池结构如图所示,下列有关该原电池的说法不正确的是( )
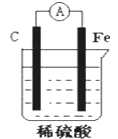
A. 能将化学能转换成电能
B. 电子从碳棒经外电路流向铁棒
C. 碳棒发生还原反应
D. 总反应为Fe+H2SO4= FeSO4+H2↑
科目:高中化学 来源: 题型:
【题目】已知:常温下浓度均为0.1 mol·L-1的下列各溶液的pH如下表所示,下列有关说法正确的是( )
溶质 | NaF | NaClO | Na2CO3 |
pH | 7.5 | 9.7 | 11.6 |
A. 在相同温度下,同浓度的三种酸溶液的导电能力顺序:H2CO3<HClO<HF
B. 若将CO2通入0.1 mol·L-1 Na2CO3溶液中至溶液呈中性,则溶液中2c(CO32-)+c(HCO3-)=0.1 mol·L-1(忽略溶液体积变化)
C. 根据上表,水解方程式ClO-+H2O![]() HClO+OH-的平衡常数K≈10-7.6
HClO+OH-的平衡常数K≈10-7.6
D. 向上述NaClO溶液中通过量CO2气体的离子方程式为:2ClO-+CO2+H2O === 2HClO+CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一块已知质量的铝镁合金,欲测定其中镁的质量分数,几位同学设计了以下三种不同的实验方案:
实验方案①:铝镁合金![]() 测定生成的气体在标准状况下的体积
测定生成的气体在标准状况下的体积
实验方案②:铝镁合金![]() 测定生成的气体在标准状况下的体积
测定生成的气体在标准状况下的体积
实验方案③:铝镁合金![]() 溶液
溶液![]() 过滤、洗涤、干燥后测定得到沉淀的质量
过滤、洗涤、干燥后测定得到沉淀的质量
对能否测定出镁的质量分数的实验方案判断正确的是( )
A. 都能B. 都不能C. ①不能,其它都能D. ②③不能,①能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液W中,可能含有K+、Na+、Mg2+、Al3+、Cu2+、NH4+、OH、Cl、CO32-、AlO2-、SiO32-中的一种或几种,其所含的阴离子的物质的量浓度相等,取一定量该溶液,向其中加入一定物质的量浓度的稀盐酸,产生沉淀的物质的量(n)与加入盐酸的体积(V)的关系如图所示,下列有关说法不正确的是
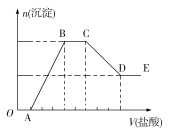
A. 该溶液中至少含有5种离子(不考虑水的电离)
B. B→C分为两个反应阶段,有两个离子反应,且反应过程中有气体生成
C. A点与D点含有同一种元素的离子能反应生成B、C两点含同一种元素的物质
D. 向W溶液中通入B→C产生的气体至过量,产生的沉淀与B点产生的沉淀不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验图示不能完成实验描述的是
选项 | 实验描述 | 实验图示 |
A | 该实验能验证氧化性: H2O2>Br2>H2SO3 |
|
B | 该实验能够实现比较HCl、H2CO3、H2SiO3酸性的强弱 |
|
C | 该实验装置用于干燥、收集并吸收多余氨气 |
|
D | 该实验能验证SO2的氧化性、还原性 |
|
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜与稀硝酸反应制备NO是化学实验教学中的重要实验之一,但是由于反应进度不易控制、NO易被氧化以及容易造成空气污染等原因在教学实践中不易操作,如图为该实验进行改进示意图。回答下列问题:

(1)组装实验装置并检验装置的气密性,检验气密性的方法为___。
(2)如果该装置气密性良好,如图装好药品,并能保证B中的两根玻璃导管能穿过塑料隔板,然后在塑料隔板上添加铜片,在反应发生前需要进行的必要操作为:打开试管C上部的止水夹,从A口通入__气体,当__时,停止从A口通气体,并用止水夹夹住A口的橡胶管。
(3)引发Cu与稀HNO3反应发生的操作:__。
(4)B中的实验现象:___。
(5)简述使实验停止的操作:___。
(6)实现无色气体迅速变为红棕色的操作:____。
(7)澄清石灰水和蘸有NaOH溶液的棉花团都可以吸收尾气,若NaOH溶液吸收NO和NO2混合气体后无气体剩余,请写出发生反应的离子方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知以下三个氧化还原反应的化学方程式:
①2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O
②2Al+Fe2O3![]() Al2O3+2Fe
Al2O3+2Fe
③2KClO3![]() 2KCl+3O2↑
2KCl+3O2↑
(1)反应①中氧化剂为________,还原剂为________。
(2)反应②中该反应中Fe2O3发生了________反应,Al发生了________反应。
(3)反应③中每生成1molO2,转移电子的物质的量是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50mL0.2mol/L的Na2SO4溶液和50mL0.2mol/L的Al2(SO4)3溶液混合后,溶液中SO42-离子的物质的量浓度为(设混合前后溶液的体积不变)( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了前20号元素中的某些元素性质的有关数据:
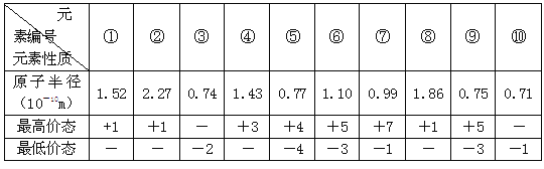
试回答下列问题:
(1)以上10种元素的原子中,失去核外第一个电子所需能量最少的是____________(填写编号)。
(2)上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是______(写分子式)。某元素R的原子半径为1.02×10-10m,该元素在周期表中位于______;若物质Na2R3是一种含有非极性共价键的离子化合物,请你写出该化合物的电子式______。
(3)元素⑤的某种单质具有平面层状结构,同一层中的原子构成许许多多的正六边形,此单质与熔融的②单质相互作用,形成某种青铜色的物质(其中的元素②用“●”表示),原子分布如图所示,该物质的化学式为______。
 。
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com