
【题目】下列实验图示不能完成实验描述的是
选项 | 实验描述 | 实验图示 |
A | 该实验能验证氧化性: H2O2>Br2>H2SO3 |
|
B | 该实验能够实现比较HCl、H2CO3、H2SiO3酸性的强弱 |
|
C | 该实验装置用于干燥、收集并吸收多余氨气 |
|
D | 该实验能验证SO2的氧化性、还原性 |
|
A. AB. BC. CD. D
科目:高中化学 来源: 题型:
【题目】最近科学家利用下列装置图成功地实现了CO2和H2O合成CH4。下列叙述错误的是( )
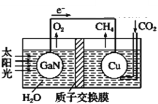
A. 电池工作时,实现了将太阳能转化为电能
B. 铜电极为正极,电极反应式为CO2+4e-+8H+=CH4+2H2O
C. 电池内 H+ 透过质子交换膜从左向右移动
D. 为提高该人工光合系统的工作效率,可向装置中加入少量稀硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
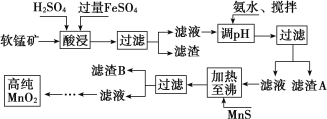
【题目】二氧化锰是制造锌锰干电池的基本材料,工业上以软锰矿、菱锰矿为原料来制备。某软锰矿主要成分为 MnO2,还含有 Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和 Cu(0.86%)等元素的化合物,其处理流程图如下:
化合物 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
Ksp 近似值 | 10-34 | 10-16 | 10-38 |
(1)硫酸亚铁在酸性条件下将 MnO2 还原为 MnSO4,酸浸时发生的主要离子反应方程式为:_____________ ;
(2)“氨水、搅拌”,其中“搅拌”不仅能加快反应速率,还能______________, 滤渣 A 的成分是 Fe(OH)3、Al(OH)3,加入氨水需调节 pH 至少达到_________________,恰好能使 Fe3+、Al3+沉淀完全(当 c≤10-5 mol·L-1 时,认为该离子沉淀完全);
(3)滤渣 B 的成分是 ________________
(4)MnO2 也可在 MnSO4-H2SO4-H2O 为体系的电解液中电解获得,其阳极反应式为:______________ 工业上采用间接氧化还原滴定法测定 MnO2 纯度,其操作过程如下:准确称量 0.920 0 g 该样品,与足量酸性 KI 溶液充分反应后,配制成 100 mL 溶液。取其中 10.00 mL,恰好与 25.00 mL 0.080 0 mol·L-1Na2S2O3溶液反应(I2 +2S 2O32-===2I-+S 4O62-)。计算可得该样品纯度为_____%(保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于Fe(OH)3胶体的叙述中,正确的是( )
A. 制备Fe(OH)3胶体的化学方程式是FeCl3+3H2O![]() Fe(OH)3↓+3HCl
Fe(OH)3↓+3HCl
B. 在制备Fe(OH)3胶体的实验中,加热煮沸时间越长,越有利于胶体的生成
C. Fe(OH)3胶体微粒能吸附阳离子,从而使Fe(OH)3胶体带有一定电荷
D. Fe(OH)3胶体能够吸附水中悬浮的固体颗粒并沉降,达到净水目的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池结构如图所示,下列有关该原电池的说法不正确的是( )
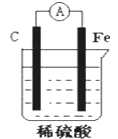
A. 能将化学能转换成电能
B. 电子从碳棒经外电路流向铁棒
C. 碳棒发生还原反应
D. 总反应为Fe+H2SO4= FeSO4+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.MgH2拥有很高的储氢密度,相对便宜的价格以及良好的可逆储氢性能,在储氢材料中具有重要作用和地位,一直都是广大研究者关注的焦点。回答下列问题:
(1)请写出MgH2的电子式:____。
(2)MgH2能与H2O反应生成白色沉淀Mg(OH)2和H2,NH3与H2O类似,MgH2与NH3反应也生成氢气,反应原理类似,请写出反应的化学方程式:____。
Ⅱ.(3)尿素(H2NCONH2)水解生成H2NCOONH4(氨基甲酸铵,简称甲铵),甲铵不稳定,迅速分解生成两种气态化合物,溶于水后,一个呈酸性,一个呈碱性,请写出甲铵受热分解的化学方程式:____。
(4)甲铵在不同条件下分解的能量变化如图所示,N过程与M过程相比,N过程活化能大大降低的原因可能是____;ΔH=___kJ·mol1。

Ⅲ.氨呈弱碱性,氨燃料与碱性燃料电池是一对较好的组合。直接氨碱性(膜)燃料电池总的化学方程式为:4NH3+3O2=2N2+6H2O,工作原理如图:
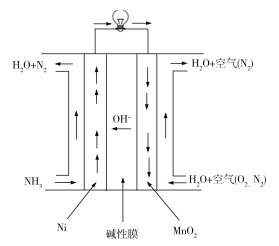
(5)MnO2电极为__极(填“正”“负”“阴”或“阳”),写出Ni电极的电极反应式:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2008年9月,中国爆发三鹿婴幼儿奶粉受污染事件,导致食用了受污染奶粉的婴幼儿产生肾结石病症,其原因是奶粉中含有三聚氰胺.三聚氰胺的分子式为C3N3(NH2)3下列有关三聚氰胺的说法不正确的是( )
A.三聚氰胺的摩尔质量为126
B.三聚氰胺中C、N、H的原子个数比为1:2:2
C.三聚氰胺中C、N两种元素的质量比为3:7
D.三聚氰胺中氮元素的质量分数约为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将甘油![]() 转化为高附加值产品是当前的热点研究方向,如甘油和水蒸气、氧气经催化重整或部分催化氧化可制得
转化为高附加值产品是当前的热点研究方向,如甘油和水蒸气、氧气经催化重整或部分催化氧化可制得![]() ,反应过程如下:
,反应过程如下:
反应Ⅰ |
| 甘油水蒸气重整 |
反应Ⅱ |
| 甘油部分氧化 |
反应Ⅲ |
| 甘油氧化水蒸气重整 |
下列说法正确的是( )
A. ![]() B. 消耗等量的甘油,反应Ⅲ的放热效果最显著
B. 消耗等量的甘油,反应Ⅲ的放热效果最显著
C. 消耗等量的甘油,反应的产氢率最高D. 甘油不溶于水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com