
| A. | 乙醇、糖类和蛋白质都是人体必需的营养物质 | |
| B. | 福尔马林可防腐,可用它保存海鲜产品 | |
| C. | 油脂在酸性条件下水解生成高级脂肪酸和甘油 | |
| D. | 合成橡胶与光导纤维属于有机高分子材料 |
 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
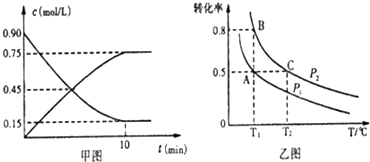 硫及其化合物有广泛应用.
硫及其化合物有广泛应用.| NH3•H2O | H2SO3 | ||
| 电离平衡常数为 (mol•L-1) | 1.7×10-5 | Ka1 | Ka2 |
| 1.54×10-2 | 1.02×10-7 | ||
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
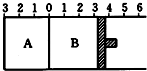 如图所示,温度不变下某容器分隔AB两部分,A容积固定不变,B有可移动的活塞,现在A中充入2molSO2和1molO2,在B中充入2mol SO3和1molN2,开始时活塞停在3处.在相同条件下发生可逆反应:2SO3(g)?2SO2(g)+O2(g),则下列说法正确的是( )
如图所示,温度不变下某容器分隔AB两部分,A容积固定不变,B有可移动的活塞,现在A中充入2molSO2和1molO2,在B中充入2mol SO3和1molN2,开始时活塞停在3处.在相同条件下发生可逆反应:2SO3(g)?2SO2(g)+O2(g),则下列说法正确的是( )| A. | A中的压强大于B中的压强 | |
| B. | A中的SO2浓度小于B中SO2浓度 | |
| C. | A中的SO3浓度小于B中SO3浓度 | |
| D. | 将A改为可移动的活塞,达平衡时,A 停在0左侧0.5 处,则B可能停在0右侧3.2处 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
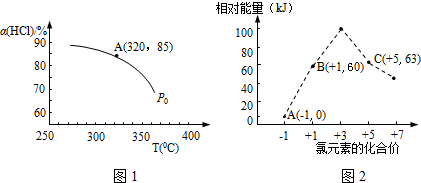
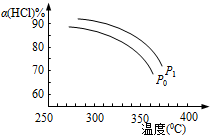 ,增大压强,平衡向正反应方向移动,αHCl增大,相同温度下HCl的平衡转化率比之前实验的大.
,增大压强,平衡向正反应方向移动,αHCl增大,相同温度下HCl的平衡转化率比之前实验的大.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com