
 硫及其化合物有广泛应用.
硫及其化合物有广泛应用.| NH3•H2O | H2SO3 | ||
| 电离平衡常数为 (mol•L-1) | 1.7×10-5 | Ka1 | Ka2 |
| 1.54×10-2 | 1.02×10-7 | ||
分析 (1)已知:①2SO2(g)+O2(g)+2H2O(l)═2H2SO4(l)△H=-457kJ•mol-1
②SO3(g)+H2O(l)═H2SO4(l)△H=-130kJ•mol-1
根据盖斯定律,①-②×2可得:2SO2(g)+O2(g)═2SO3(g);
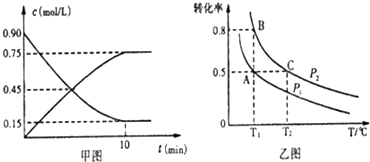
(2)①SO2为反应物,随反应进行浓度减小,而SO3为生成物,随反应进行浓度增大,根据v=$\frac{△c}{△t}$计算v(SO3),再利用速率之比等于化学计量数之比计算v(O2);
②正反应为气体体积减小的反应,增大压强平衡正向移动,O2的平衡转化率增大;
平衡常数只受温度影响,与压强无关,温度相同,则平衡常数相等,正反应为放热反应,升高温度平衡逆向移动,平衡常数减小;
(3)①如果在25℃时,相同物质的量的SO2与NH3溶于水,发生反应:SO2+NH3+H2O=NH4HSO3;
根据电荷守恒c(H+)+c(NH4+)=c(OH-)+c(HSO3-)+2c(SO32-),由微粒守恒可知c(NH3•H2O)+c(NH4+)=c(H2SO3)+c(HSO3-)+c(SO32-);
②HSO3-的水解平衡常数Kh=$\frac{1{0}^{-14}}{1.52×1{0}^{-2}}$=6.5×10-13<Ka2=1.02×10-7,NH4+的水解平衡常数为$\frac{1{0}^{-14}}{1.7×1{0}^{-5}}$=5.9×10-10<Ka2=1.02×10-7,则NH4+的水解程度小于HSO3-的电离,溶液呈酸性,溶液中氢离子源于铵根离子水、HSO3-的电离、水的电离,氢离子浓度大于亚硫酸根浓度.
解答 解:(1)已知:①2SO2(g)+O2(g)+2H2O(l)═2H2SO4(l)△H=-457kJ•mol-1
②SO3(g)+H2O(l)═H2SO4(l)△H=-130kJ•mol-1
根据盖斯定律,①-②×2可得:2SO2(g)+O2(g)═2SO3(g)△H=-197kJ•mol-1,
故答案为:2SO2(g)+O2(g)═2SO3(g)△H=-197kJ•mol-1;
(2)①SO2为反应物,随反应进行浓度减小,而SO3为生成物,随反应进行浓度增大,由图可知△c(SO3)=0.75mol/L,则v(SO3)=$\frac{0.75mol/L}{10min}$=0.075mol/(L.min),速率之比等于化学计量数之比,则v(O2)=$\frac{1}{2}$v(SO3)=0.0375mol/(L.min),
故答案为:0.0375mol/(L.min);
②由图可知压强P2时氧气转化率更大,正反应为气体体积减小的反应,增大压强平衡正向移动,O2的平衡转化率增大,故氧气P1<P2;
平衡常数只受温度影响,与压强无关,A、B温度相同,则平衡常数相等,C点温度最高,正反应为放热反应,升高温度平衡逆向移动,平衡常数减小,故平衡常数KA=KB>KC,
故答案为:<;KA=KB>KC;平衡常数只受温度影响,与压强无关,A、B温度相同,则平衡常数相等,C点温度最高,正反应为放热反应,升高温度平衡逆向移动,平衡常数减小;
(3)①如果在25℃时,相同物质的量的SO2与NH3溶于水,发生反应:SO2+NH3+H2O=NH4HSO3,反应离子方程式为:SO2+NH3+H2O=NH4++HSO3-;
根据电荷守恒c(H+)+c(NH4+)=c(OH-)+c(HSO3-)+2c(SO32-),所得溶液中c(H+)-c(OH-)=c(HSO3-)+2c(SO32-)-c(NH4+),
由微粒守恒可知c(NH3•H2O)+c(NH4+)=c(H2SO3)+c(HSO3-)+c(SO32-),则所得溶液中c(H+)-c(OH-)=c(SO32-)+c(NH3•H2O)-c(H2SO3),
故答案为:SO2+NH3+H2O=NH4++HSO3-;CD;
②HSO3-的水解平衡常数Kh=$\frac{1{0}^{-14}}{1.52×1{0}^{-2}}$=6.5×10-13<Ka2=1.02×10-7,NH4+的水解平衡常数为$\frac{1{0}^{-14}}{1.7×1{0}^{-5}}$=5.9×10-10<Ka2=1.02×10-7,则NH4+的水解程度小于HSO3-的电离,溶液呈酸性,溶液中氢离子源于铵根离子水、HSO3-的电离、水的电离,氢离子浓度大于亚硫酸根浓度,各离子浓度由大到小的顺序为:c(NH4+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-),
故答案为:c(NH4+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-).
点评 本题考查热化学方程书写、化学平衡计算与影响因素、反应速率计算、化学平衡图象、离子浓度比较、电离平衡常数应用等,是对学生综合能力的考查,(3)中离子浓度大小比较为易错点、难点,关键是判断亚硫酸氢根的水解程度与电离程度相对大小.


科目:高中化学 来源: 题型:解答题
 碳、氮及其化合物在工农业生产生活中有着重要作用.请回答下列问题:
碳、氮及其化合物在工农业生产生活中有着重要作用.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知25℃时部分弱电解质的电离平衡常数数据如表所示:
已知25℃时部分弱电解质的电离平衡常数数据如表所示:| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平衡常数 | Ka=1.8×10-5 | Kal=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
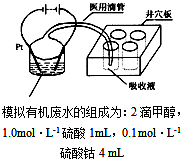 汽车作为一种现代交通工具正在进入千家万户,汽车尾气中含有CO、NO2等有毒气体,其污染问题也成为当今社会急需解决的问题.
汽车作为一种现代交通工具正在进入千家万户,汽车尾气中含有CO、NO2等有毒气体,其污染问题也成为当今社会急需解决的问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不变 | B. | 增大 | C. | 减小 | D. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇、糖类和蛋白质都是人体必需的营养物质 | |
| B. | 福尔马林可防腐,可用它保存海鲜产品 | |
| C. | 油脂在酸性条件下水解生成高级脂肪酸和甘油 | |
| D. | 合成橡胶与光导纤维属于有机高分子材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH5中既有共价键又有离子键 | |
| B. | NH5的电子式为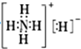 | |
| C. | 1 mol NH5中含有5NA个N-H键(NA表示阿伏加德罗常数) | |
| D. | 它与水反应的离子方程式为NH4++H-+H2O═NH3•H2O+H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com