
【题目】充满NO2和O2混合气体30mL的试管倒立于水中,最终试管中剩余5mL气体,则原试管中NO2和O2的体积比可能是
A.1︰1B.3︰1C.5︰1D.9︰1
【答案】D
【解析】
NO2和O2混合气体与水可能的反应式有:4NO2+O2+2H2O=4HNO3,3NO2+H2O=2HNO3+NO,根据反应的方程式利用讨论的方法进行计算原混合气体中NO2和O2的体积。
若氧气过量,则剩余5mL气体为氧气,设参加反应的氧气的体积为x,则:
![]()
4x+x=30mL5mL=25mL,x=5mL,所以氧气的体积为:5mL+5mL=10mL,二氧化氮体积为:30mL10mL=20mL,NO2和O2的体积比=2:1;
若剩余5mL气体为NO,设氧气的体积为y,
![]()

![]() ,则y=3mL,则氧气体积为3mL,二氧化氮体积为:30mL3mL=27mL,NO2和O2的体积比=9:1,答案选D。
,则y=3mL,则氧气体积为3mL,二氧化氮体积为:30mL3mL=27mL,NO2和O2的体积比=9:1,答案选D。


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A.将金属钠投入水中: Na+2H2O= Na+ +2OH-+H2↑
B.向AlCl3溶液中加入过量氨水: Al3+ +4NH3·H2O = AlO![]() +4NH
+4NH![]() +2H2O
+2H2O
C.向水中通入NO2: 2NO2+H2O= 2H++ NO![]() +NO
+NO
D.向Na2SiO3溶液中滴加稀盐酸: SiO![]() +2H+ = H2SiO3↓
+2H+ = H2SiO3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是
A.![]() 可表示单核10电子粒子基态时的电子排布
可表示单核10电子粒子基态时的电子排布
B.电子仅在激发态跃迁到基态时才会产生原子光谱
C.同一原子能层越高,s电子云的半径越大
D.N、O、F电负性逐渐增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)据科技日报网报道,南开大学科研团队借助镍和苯基硼酸共催化剂,首次实现烯丙醇高效、绿色合成。烯丙醇及其化合物可制成甘油、医药、农药、香料,合成维生素E和KI及天然抗癌药物紫杉醇中都含有关键的烯丙醇结构。丙烯醇的结构简式为CH2=CH-CH2OH。请回答下列问题:
①基态镍原子的价电子排布图为________。
②1 mol CH2=CH-CH2OH含有σ键的数目为________,烯丙醇分子中碳原子的杂化类型为___。
③Ni2+能形成多种配离子,如[Ni(NH3)6]2+、[Ni(CN)2]2- 和[Ni(SCN)2]- 等,与CN-互为等电子体的阴离子为_____。
(2)乙炔是有机合成工业的一种原料。工业上曾用CaC2与水反应生成乙炔。
①CaC2中C22-中碳与碳之间存在碳碳三键,C22-与O22+互为等电子体,O22+的电子式可表示为_______。
②乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N)。丙烯腈分子中σ键和π键数目比是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷(As)是第四周期VA族元素,可以形成As2S3、H3AsO3、H3AsO4等化合物,用途广泛。
完成下列填空:
(1)砷原子核外有__个电子层,最外层有__个电子,写出砷原子最外层电子的轨道表示式:__。
(2)将砷与VA族所有短周期元素的原子半径,按从小到大的顺序排列:__(用元素符号表示)。
(3)溴位于VIIA族且与砷同周期,比较溴、砷最高价氧化物对应水化物酸性的强弱:__强于__(填物质的化学式)。
(4)周期表中,铝和砷都在金属和非金属过渡线附近,举一例说明铝元素具有非金属性:__。
(5)已知:稀Na3AsO3溶液、稀碘水和稀NaOH溶液混合,发生如下反应:AsO33-(aq)+I2(aq)+2OH-![]() AsO43-(aq)+2I-(aq)+H2O(l),溶液中c(AsO43-)与反应时间(t)的关系如图所示。
AsO43-(aq)+2I-(aq)+H2O(l),溶液中c(AsO43-)与反应时间(t)的关系如图所示。
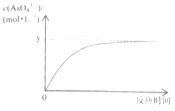
①写出该反应平衡常数的表达式K=___。
②不能判断反应达到平衡状态的是___(选填编号)。
A.溶液的pH不再变化
B.v(I-)=2v(AsO33-)
C.c(AsO33-)/c(I-)不再变化
D.c(I-)=2ymol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可燃冰主要含有甲烷水合物(CH4·nH2O),还含少量CO2等物质。
(1)可燃冰中,CH4分子的空间构型为_______,CO2的电子式为________
(2)工业利用甲烷制氢气,化学方程式为CH4(g) + H2O(g)CO(g) + 3H2(g)
①下列措施能加快反应速率的是_______
a.降低温度 b.增加CH4浓度 c.使用催化剂
②若上述反应在恒容的密闭容器中进行,下列叙述中能说明该反应已达平衡状态的是______
a.c(H2) = 3c(H2O) b.混合气体的质量不再变化 c.单位时间内生成1 mol CO,同时消耗3 mol H2
(3)某种甲烷燃料电池工作原理如图所示:
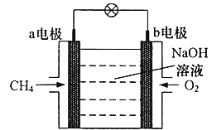
①电子移动方向为________,(填“a→b"或“b→a")
②b电极的电极反应式为____________。
(4)甲烷可催化还原NO,反应历程如图所示:

①该历程中,反应i为CH4+ 12Fe2O3=8Fe3O4+CO2+2H2O,
则反应ii的化学方程式为____________
②工业上催化还原2molNO,理论上需要______LCH4 (标准状况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.工业以软锰矿(主要成分是MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料制备高性能的磁性材料碳酸锰(MnCO3)。其工业流程如下:
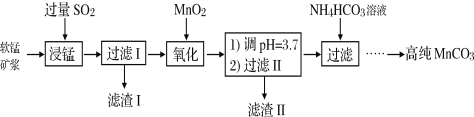
(1)浸锰过程中Fe2O3与SO2反应的离子方程式为Fe2O3+SO2+2H+=2Fe2++SO42-+H2O,该反应是经历以下两步反应实现的。
ⅰ:Fe2O3+6H+ =2Fe3++3H2O
ⅱ:____________________________________________(离子方程式)。
(2)过滤Ⅰ所得滤液中主要存在的两种金属阳离子为____________(填离子符号)。
(3)氧化过程中被MnO2氧化的物质有(写化学式):____________________。
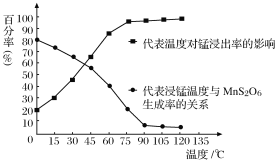
(4) “浸锰”反应中往往有副产物MnS2O6生成,温度对“浸锰”反应的影响如图所示,为减少MnS2O6的生成,“浸锰”的适宜温度是_________;向过滤Ⅱ所得的滤液中加入NH4HCO3溶液时温度不宜太高的原因是______________________。
(5).加入NH4HCO3溶液后,生成MnCO3沉淀,同时还有气体生成,写出反应的离子方程式:_______________________________________________________。
Ⅱ.重金属元素铬的毒性较大,含铬废水需经处理达标后才能排放。
酸性条件下,六价铬主要以Cr2O72-形式存在,工业上常用电解法处理含Cr2O72-的废水。实验室用如图装置模拟处理含Cr2O72-废水,阳极反应式Fe-2e-=Fe2+,阴极反应式2H++2e-=H2↑随着电解进行,阴极附近pH升高。
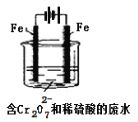
(1)电解时能否用Cu电极来代替Fe电极?____(填“能”或“不能”),理由是______________________。
(2)电解时阳极附近溶液中Cr2O72-转化为Cr3+的离子方程式为______________________________。
(3)上述反应得到的金属阳离子在阴极区可沉淀完全,从其对水的电离平衡影响角度解释其原因__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近科学家研制的一种新型“微生物电池”可以将污水中的有机物转化为H2O和CO2,同时产生电能,其原理示意如图。下列有关该电池的说法正确的是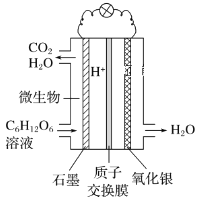
A.氧化银电极上的反应为Ag2O+2e-=2Ag+O2-
B.石墨电极上的反应为C6H12O6+6H2O-24e-=6CO2↑+24H+
C.每转移4 mol电子,石墨电极产生22.4 L CO2气体
D.每30 g C6H12O6参与反应,有4 mol H+经质子交换膜进入负极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.烟道气中的NO2是主要的大气污染物之一,为了监测其含量,选用如下检测方法。回答下列问题:
将VL气样通入适量酸化的H2O2溶液中,使NO2完全被氧化成NO3-,加水稀释至100.00mL。量取20.00mL该溶液,加入v1mLc1mol·L-1 FeSO4标准溶液(过量),充分反应后,用c2mol·L-1 K2Cr2O7标准溶液滴定剩余的Fe2+,终点时消耗v2mL。
(1)NO2被H2O2氧化为NO3-的离子方程式为____________________________________。
(2)加水稀释到100.00ml所用的玻璃仪器除量筒、烧杯、玻璃棒、胶头滴管外,还需要__________________。
(3)滴定过程中发生下列反应:
3Fe2++NO3-+4H+=NO↑+3Fe3++2H2O
Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
则气样中NO2的含量为___________mg/L。
(4)下列操作会使滴定结果偏高的是____
A.滴定管未用标准液润洗 B.锥形瓶洗净后还存留少量的水
C.滴定管滴定前读数正确,滴定后俯视读数 D.FeSO4标准溶液部分变质
II.常温下,用酚酞作指示剂,用0.10mol·L-1 NaOH溶液分别滴定20.00mL浓度均为0.10mol·L-1的 CH3COOH溶液和HCN溶液所得滴定曲线如图。
(已知:CH3COOH、 HCN的电离平衡常数分别为1.75×10-5、6.4×10-10)
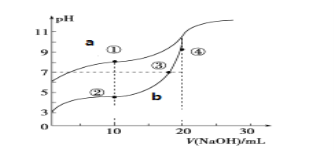
(1)图___(a或b)是NaOH溶液滴定HCN溶液的pH变化的曲线,判断的理由是_______________________。
(2)点③所示溶液中所含离子浓度的从大到小的顺序:_______________________。
(3)点①和点②所示溶液中:c(CH3COO-)-c(CN-)___c(HCN)-c(CH3COOH)(填“>、<或=”)
(4)点②③④所示的溶液中水的电离程度由大到小的顺序是:____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com