
【题目】Q、R、X、Y、Z五种元素的原子序数依次递增。已知:①Z的原子序数为29,其余的均为短周期主族元素;Y原子的价电子(外围电子)排布为msnmpn;②R原子核外L层电子数为奇数;③Q、X原子p轨道的电子数分别为2和4。请回答下列问题:
(1)Z2+的核外电子排布式是________。
(2)在[Z(NH3)4]2+离子中,Z2+的空轨道接受NH3分子提供的________形成配位键。
(3)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是________。
a.稳定性:甲>乙,沸点:甲>乙 b.稳定性:甲>乙,沸点:甲<乙
c.稳定性:甲<乙,沸点:甲<乙 d.稳定性:甲<乙,沸点:甲>乙
(4)Q、R、Y三种元素的第一电离能数值由小到大的顺序为________(用元素符号作答)。
(5)Q的一种氢化物相对分子质量为26,其中分子中的σ键与π键的键数之比为________,其中心原子的杂化类型是________。
(6)某元素原子的价电子构型为3d54s1,该元素属于________区元素,元素符号是________。
【答案】 1s22s22p63s23p63d9 孤电子对 b Si<C<N 3∶2 sp杂化 d Cr
【解析】Z的原子序数为29,Z为Cu元素;R原子核外L层电子数为奇数,R为第二周期元素,Q的p轨道电子数为2,Q的原子序数小于R,Q为C元素;Y原子的价电子排布为msnmpn,Y原子的价电子排布为ms2mp2,Y为第IVA族元素,Y的原子序数介于Q与Z之间,Y为Si元素;X原子p轨道的电子数为4,X的原子序数介于Q与Y之间,X为O元素;R的原子序数介于Q与X之间,R为N元素。
(1)Z2+的核外电子排布式为1s22s22p63s23p63d9。
(2)在[Cu(NH3)4]2+离子中,Cu2+的空轨道接受NH3分子中N原子提供的孤电子对形成配位键。
(3)Q、Y形成的最简单气态氢化物依次为CH4(甲)、SiH4(乙),稳定性:CH4![]() SiH4,沸点:CH4
SiH4,沸点:CH4![]() SiH4。
SiH4。
(4)C、N、Si的第一电离能由小到大的顺序为Si![]() C
C![]() N。
N。
(5)Q的一种氢化物相对分子质量为26,该氢化物为CH![]() CH,CH
CH,CH![]() CH中σ键与π键的键数之比为3:2。其中C原子为sp杂化。
CH中σ键与π键的键数之比为3:2。其中C原子为sp杂化。
(6)某元素原子的价电子构型为3d54s1,该元素属于d区元素,元素符号是Cr。
Z的原子序数为29,Z为Cu元素;R原子核外L层电子数为奇数,R为第二周期元素,Q的p轨道电子数为2,Q的原子序数小于R,Q为C元素;Y原子的价电子排布为msnmpn,Y原子的价电子排布为ms2mp2,Y为第IVA族元素,Y的原子序数介于Q与Z之间,Y为Si元素;X原子p轨道的电子数为4,X的原子序数介于Q与Y之间,X为O元素;R的原子序数介于Q与X之间,R为N元素。
(1)Z为Cu元素,Cu原子核外有29个电子,基态Cu原子的核外电子排布式为1s22s22p63s23p63d104s1,Z2+的核外电子排布式为1s22s22p63s23p63d9。
(2)在[Cu(NH3)4]2+离子中,Cu2+的空轨道接受NH3分子中N原子提供的孤电子对形成配位键。
(3)Q、Y形成的最简单气态氢化物依次为CH4(甲)、SiH4(乙),由于C-H键的键长小于Si-H键,C-H键的键能大于Si-H键,稳定性:CH4![]() SiH4;由于CH4的相对分子质量小于SiH4的相对分子质量,CH4分子间作用力小于SiH4分子间作用力,沸点:CH4
SiH4;由于CH4的相对分子质量小于SiH4的相对分子质量,CH4分子间作用力小于SiH4分子间作用力,沸点:CH4![]() SiH4;答案选b。
SiH4;答案选b。
(4)根据同周期从左到右第一电离能呈增大趋势,第一电离能C![]() N;同主族从上到下第一电离能逐渐减小,第一电离能C
N;同主族从上到下第一电离能逐渐减小,第一电离能C![]() Si;C、N、Si的第一电离能由小到大的顺序为Si
Si;C、N、Si的第一电离能由小到大的顺序为Si![]() C
C![]() N。
N。
(5)Q的一种氢化物相对分子质量为26,该氢化物为CH![]() CH,CH
CH,CH![]() CH的结构式为H—C
CH的结构式为H—C![]() C—H,单键全为σ键,三键中含1个σ键和2个π键,CH
C—H,单键全为σ键,三键中含1个σ键和2个π键,CH![]() CH中σ键与π键的键数之比为3:2。CH
CH中σ键与π键的键数之比为3:2。CH![]() CH中每个碳原子形成2个σ键,C原子上没有孤电子对,C原子为sp杂化。
CH中每个碳原子形成2个σ键,C原子上没有孤电子对,C原子为sp杂化。
(6)某元素原子的价电子构型为3d54s1,由于最后电子填入的能级符号为3d,该元素属于d区元素,元素符号是Cr。


科目:高中化学 来源: 题型:
【题目】下表是生活生产中常见的物质,表中列出了它们的(主要)成分。
编号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ |
名称 | 酒精 | 醋酸 | 火碱 | 食盐 | 铜导线 | 亚硫酸酐 | 苏打 |
主要成分 | CH3CH2OH | CH3COOH | NaOH | NaCl | Cu | SO2 | Na2CO3 |
(1)请你对表中①~⑦的主要成分进行分类(填编号):属于电解质的是______,属于非电解质_______。
(2)过量②的水溶液与⑦反应的离子方程式______________________。
(3)某同学用⑤和浓硫酸共热来制备⑥,化学方程式为:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
①请用单线桥标出电子转移的情况____________;
②浓H2SO4表现出来的性质是:_______;当电子转移0.1mol时,消耗氧化剂的物质的量为_______。
(4)如图表示某同学配制480mL 0.5mol/L 的NaOH溶液的部分操作示意图,其中有错误的是_______,这样操作所配制的溶液比要求的浓度要_________ (填“偏高”、“偏低”、“不影响”)。配制应称取NaOH________g。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应是一类重要的反应。
①用铝与软锰矿(主要成分为MnO2)冶炼锰的原理是________________(用化学方程式来表示)。
②MnO2在H2O2分解反应中作催化剂。若将适量MnO2加入酸化的H2O2的溶液中,MnO2溶解产生Mn2+,该反应的离子方程式是____________________。
③某温度下将氯气通入KOH溶液里,反应后得到KCl、KClO、KClO3的混合溶液,经测定ClO-与ClO3-的物质的量浓度之比为1:1,则氯气与KOH反应时,被还原的氯元素和被氧化的氯元素的质量之比为___________。
④12mL 0.lmol/L Na2SO3溶液恰好与4mL 0.lmol/L K2Cr2O7溶液反应,则元素Cr在还原产物中的化合价为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氯化铁与氯化亚铁的混合物,现要测定其中铁元素的质量分数,实验按以下步骤进行:

Ⅰ.请根据上面流程,回答以下问题:
(1)操作Ⅰ所用到的玻璃仪器除烧杯、玻璃棒外,还必须有________、________(填仪器名称)。
(2)请写出加入溴水发生的离子反应方程式:_______________________________________。
(3)将沉淀物加热,冷却至室温,用天平称量其质量为b1g,再次加热并冷却至室温称量其质量为b2g,若b1-b2=0.3 g,则接下来还应进行的操作是______________________________。若蒸发皿质量是W1g,蒸发皿与加热后固体总质量是W2g,则样品中铁元素的质量分数是____________。
Ⅱ.有同学提出,还可以采用以下方法来测定:

(4)溶解样品改用了硫酸,而不再用盐酸,为什么? ______________________________。
(5)选择的还原剂是否能用铁________(填“是”或“否”),原因是:___________________。
(6)若滴定用掉cmol·L-1KMnO4溶液bmL,则样品中铁元素的质量分数是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰基丙烯酸酯在碱性条件下能快速聚合为 从而具有胶黏性。某种氰基丙烯酸酯(G)的合成路线如下:
从而具有胶黏性。某种氰基丙烯酸酯(G)的合成路线如下:

已知:
①A的相对分子质量为58,氧元素质量分数为0.276,核磁共振氢谱显示为单峰
②
回答下列问题:
(1)A 的化学名称为__________________,。
(2)B的结构简式为____________________。其核磁共振氢谱显示为______组峰,峰面积比为_______。
(3)由C生成D的反应类型为_____________。
(4)由D生成E的化学方程式为__________________________________________________________。
(5)G中的官能团有__________、__________、__________。(填官能团名称)
(6)G的同分异构体中,与G具有相同官能团且能发生银镜反应的共有___________种。(不含立体结构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在氨水中存在电离平衡:NH3·H2O![]() NH4++OH-,下列情况能引起电离平衡向右移动的有( )
NH4++OH-,下列情况能引起电离平衡向右移动的有( )
①加NH4Cl固体 ②加NaOH溶液 ③通HCl ④加CH3COOH溶液 ⑤加水
A. ①③⑤ B. ①④⑤ C. ③④⑤ D. ①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解法制备硼酸[H3BO3或B(OH) 3]的工作原理如图所示(阳膜和阴膜分别只允许阳离子和阴离子通过)。下列有关说法正确的是( )
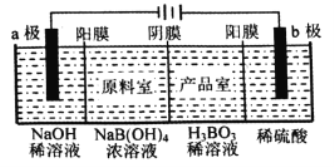
A. 阴极与阳极产生的气体体积比为1:2 B. b极的电极反应式为2H2O-2eˉ=O2↑+4H+
C. 产品室中发生的反应是B(OH)3+OHˉ=B(OH)4ˉ D. 每增加1 mol H3BO3产品,NaOH溶液增重22g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用无机矿物资源生产部分材料的流程示意图如下。下列说法正确的是( )

(注:铝土矿中含有A12O3、SiO2、Fe2O3)
A. 在铝土矿制备较高纯度A1的过程中只用到NaOH溶液、CO2气体、冰晶石
B. 石灰石、纯碱、石英、玻璃都属于盐,都能与盐酸反应
C. 在制粗硅时,氧化剂与还原剂的物质的量之比为1∶2
D. 黄铜矿(CuFeS2)与O2反应产生的Cu2S、SO2均是还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如图所示(部分物质与条件己略去)。已知A、C是由两种相同元素组成的物质,其中A的摩尓质量为65g·mol-1,C是白色粉末且焰色反应呈黄色,I是最常见的液体,E是一种红棕色气体,B、F都是无色气体单质。请回答下列问题:

(1)K的电子式为:___________________________。
(2)E的化学式为:___________________________。
(3)写出反应①的化学方程式:___________________________。
(4)写出反应②的离子方程式:________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com