
【题目】香豆素类化合物具有抗病毒、抗癌等多种生物活性,香豆素-3-羧酸可由水杨醛制备。
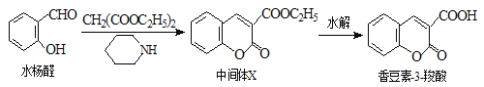
下列说法正确的是( )
A.水杨醛分子中所有原子可能处于同一平面上
B.香豆素-3-羧酸能使酸性高锰酸钾溶液褪色
C.中间体X易溶于水
D.水杨醛的不饱和度是4
科目:高中化学 来源: 题型:
【题目】25℃时,草酸(H2C2O4)的Ka1=5.4×10-2,Ka2=5.4×10-5,是一种常用的除锈剂。0.1mol/L的NaHC2O4溶液中,下列粒子的物质的量浓度关系不正确的是( )
A.c(Na+)>c(HC2O4-)>c(OH-)>c(H2C2O4)>c(H+)
B.c(Na+)=c(C2O42-)+c(HC2O4-)+c(H2C2O4)
C.c(Na+)+c(H+)= c(HC2O4-)+2c(C2O42-)+c(OH-)
D.c(H+)+c(H2C2O4)= c(OH-)+c(C2O42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pKa= -lgKa,25℃时,H2SO3的pKa1=1.85,pKa2=7.19。常温下,用0.1mol/LNaOH溶液滴定20mL 0.1mol/L H2SO3溶液的滴定曲线如图所示。下列说法不正确的是( )
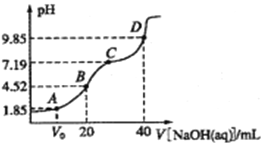
A.A点所得溶液中:Vo等于l0mL
B.B点所得溶液中:c(Na+)+ c(H+)=2c(SO32-)+ c(HSO3-)+ c(OH-)
C.C点所得溶液中:c(Na+)>3c(HSO3-)
D.D点所得溶液中水解平衡常数:Kh1=10-6.81
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是一种有机醚,可由链烃A(分子式为C4H6)通以下路线制得,下列说法正确的是( )
是一种有机醚,可由链烃A(分子式为C4H6)通以下路线制得,下列说法正确的是( )
A![]() B
B![]() C
C![]()
![]()
A.A的结构简式是CH2=CHCH2CH3
B.C在Cu或Ag做催化剂、加热条件下能被O2氧化为醛
C.B中含有的官能团有溴原子、碳碳双键
D.①②③的反应类型分别为加成反应、取代反应、消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁(![]() )是一种用途广泛的化工原料,工业上常用废铁屑和稀硫酸制备。
)是一种用途广泛的化工原料,工业上常用废铁屑和稀硫酸制备。
实验室通过图7装置模拟其制备过程。请回答下列问题:
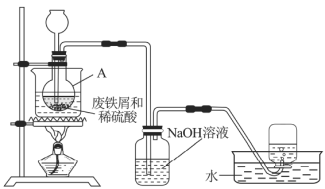
(1)进行实验之前需检查整套装置的______。装置甲中仪器A的名称是______,铁和稀硫酸反应后所得溶液呈______色。
(2)常温下废铁屑和稀硫酸反应较慢,而直接加热时温度过高又可能产生![]() 等副产物,因此,采用水浴加热,并使用过量的
等副产物,因此,采用水浴加热,并使用过量的![]() 将可能产生的
将可能产生的![]() 还原成
还原成![]() 。
。![]() 还原
还原![]() 的离子方程式为______________。
的离子方程式为______________。
(3)为验证反应后A中溶液是否含![]() ,取A中少量溶液快速冷却后,迅速滴入几滴
,取A中少量溶液快速冷却后,迅速滴入几滴![]() 溶液,溶液颜色无明显变化,说明A中溶液__________(填“含有”或“不含”)
溶液,溶液颜色无明显变化,说明A中溶液__________(填“含有”或“不含”)![]() 。
。
(4)废铁屑中含有硫化物杂质,故反应中会生成少量的![]() 气体。因此,装置乙中
气体。因此,装置乙中![]() 溶液的主要作用是______,装置丙中集气瓶收集到的气体主要是________。
溶液的主要作用是______,装置丙中集气瓶收集到的气体主要是________。
(5)将![]() 废铁屑(
废铁屑(![]() 单质的质量分数为80%,杂质为
单质的质量分数为80%,杂质为![]() 和
和![]() )与
)与![]() 的
的![]() 溶液充分反应,
溶液充分反应,![]() 的理论产量为____
的理论产量为____![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃A的相对分子质量为84。回答下列问题:
(1)该烃的分子式为___,下列物质与A以任意比例混合,若总物质的量一定,充分燃烧消耗氧气的量不变的是___(填序号)。
a.C7H12O2 b.C6H14 c.C6H14O2 d.C7H14O2
(2)若烃A为链烃,与HBr加成后只能得到一种产物,且该烃的一氯代物只有一种。
①A的结构简式为___;
②链烃A与溴的CCl4溶液反应生成B;B与NaOH的醇溶液共热可得到D,D分子中无溴原子。请写出由B制备D的化学方程式:___;
(3)若核磁共振氢谱显示链烃A有三组不同的峰,峰面积比为3∶2∶1,则A的可能的结构有几种___(不考虑顺反异构)。
(4)若A不能使溴水褪色,且其一氯代物只有一种,则A的结构简式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅精矿可用于冶炼金属铅,其主要成分为PbS。
I.火法炼铅将铅精矿在空气中焙烧,生成PbO和SO2。
①用铅精矿火法炼铅的反应的化学方程式为___。
②火法炼铅的废气中含低浓度SO2,可将废气通入过量氨水中进行处理,反应的离子方程式为___。
II.湿法炼铅在制备金属铅的同时,还可制得硫磺,相对于火法炼铅更为环保。湿法炼铅的工艺流程如图:

已知:①不同温度下PbCl2的溶解度如下表所示。

②PbCl2为能溶于水的弱电解质,在Cl-浓度较大的溶液中,存在平衡:PbCl2(aq)+2Cl-(aq)![]() PbCl42-(aq)。
PbCl42-(aq)。
(3)铅精矿浸取后“趁热过滤”的原因是___。
(4)操作a为加适量水稀释并冷却,该操作有利于滤液1中PbCl2的析出。试分析“加适量水稀释”可能的原因是___。
(5)将溶液3和滤液2分别置于如图所示电解装置的两个极室中,可制取金属铅并使浸取液中的FeCl3再生。

①溶液3应置于___(填“阴极室”或“阳极室”)中。
②滤液2电解后可实现FeCl3的再生,该电极的电极反应式___。
③若铅精矿的质量为ag,铅浸出率为b,当电解池中通过cmol电子时,金属铅全部析出,铅精矿中PbS的质量分数为___(用a、b、c的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】结构的研究是有机化学最重要的研究领域.某有机物X(C12H13O6Br)分子中含有多种官能团,其结构简式如下:(其中Ⅰ、Ⅱ为未知部分的结构).

为推测X的分子结构,进行如图转化:
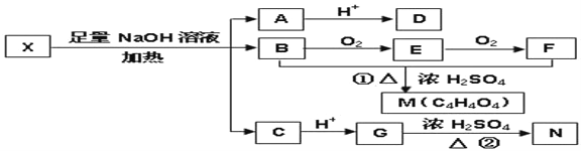
已知向D的水溶液中滴入FeCl3溶液显紫色,对D的结构进行光谱分析,在氢核磁共振谱上显示只有两种信号.M、N互为同分异构体,M中含有一个六原子环,N能使溴的四氯化碳溶液褪色,G能与NaHCO3溶液反应.请回答:
(1)G分子所含官能团的名称是__;
(2)D不可以发生的反应有(选填序号)__;
①加成反应 ②消去反应 ③氧化反应 ④取代反应
(3)写出上图转化中反应①和②的化学方程式
①B+F→M__;
②G→N__;
(4)已知向X中加入FeCl3溶液,能发生显色反应,则X的结构简式是:___________,1mol该 X与足量的NaOH溶液作用,最多可消耗NaOH__mol;
(5)有一种化工产品的中间体W与G互为同分异构体,W的分子中只含有羧基、羟基和醛基三种官能团,且同一个碳原子上不能同时连有两个羟基.则W的分子结构有__种,写出任意一种的结构简式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(卷号)10000
(题号)2427322248593408
钴的化合物在工业生产、生命科技等行业有重要应用。
(1)Co2+的核外电子排布式为____,Co的第四电离能比Fe的第四电离能要小得多,原因是____。
(2)Fe、Co均能与CO形成配合物,如Fe(CO)5、Co2(CO)8的结构如图1、图2所示,图1中1molFe(CO)5含有____mol配位键,图2中C原子的杂化方式为____,形成上述两种化合物的四种元素中电负性最大的是____(填元素符号)。
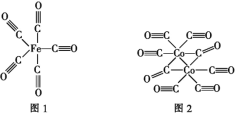
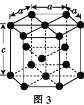
(3)金属钴的堆积方式为六方最密堆积,其配位数是____,钴晶体晶胞结构如图3所示,该晶胞中原子个数为____;该晶胞的边长为anm,高为cnm,该晶胞的密度为____(NA表示阿伏加德罗常数的值,列出代数式)g·cm-3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com