
【题目】(卷号)10000
(题号)2427322248593408
钴的化合物在工业生产、生命科技等行业有重要应用。
(1)Co2+的核外电子排布式为____,Co的第四电离能比Fe的第四电离能要小得多,原因是____。
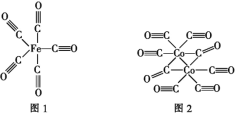
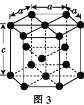
(2)Fe、Co均能与CO形成配合物,如Fe(CO)5、Co2(CO)8的结构如图1、图2所示,图1中1molFe(CO)5含有____mol配位键,图2中C原子的杂化方式为____,形成上述两种化合物的四种元素中电负性最大的是____(填元素符号)。
(3)金属钴的堆积方式为六方最密堆积,其配位数是____,钴晶体晶胞结构如图3所示,该晶胞中原子个数为____;该晶胞的边长为anm,高为cnm,该晶胞的密度为____(NA表示阿伏加德罗常数的值,列出代数式)g·cm-3。
【答案】![]() 或
或![]() Co失去三个电子后会变成
Co失去三个电子后会变成![]() ,更容易再失去一个电子形成半满状态
,更容易再失去一个电子形成半满状态![]() ,Fe失去三个电子后会变成
,Fe失去三个电子后会变成![]() ,达到半充满的稳定状态,更难再失去一个电子 10 sp、sp2 O 12 6
,达到半充满的稳定状态,更难再失去一个电子 10 sp、sp2 O 12 6 ![]()
【解析】
(1) Co 是27号元素,Co2+核外有25个电子;Co的第四电离能是失去3d6上的1个电子消耗的能量,Fe的第四电离能是失去3d5上的1个电子消耗的能量;
(2)CO分子中有1个配位键,铁原子与碳原子通过配位键结合;双键C原子的杂化方式为sp2、三键C原子的杂化方式为sp;元素非金属性越强电负性越大;
(3)六方最密堆积,原子配位数是12;利用“均摊原则”计算Co原子数;根据![]() 计算;
计算;
(1) Co2+核外有25个电子,核外电子排布式是![]() 或
或![]() ;原子轨道处于全满、半满、全空为稳定结构,Co失去三个电子后会变成
;原子轨道处于全满、半满、全空为稳定结构,Co失去三个电子后会变成![]() ,更容易再失去一个电子形成半满状态
,更容易再失去一个电子形成半满状态![]() ,Fe失去三个电子后会变成
,Fe失去三个电子后会变成![]() ,达到半充满的稳定状态,更难再失去一个电子;
,达到半充满的稳定状态,更难再失去一个电子;
(2)1个CO分子中有1个配位键,铁原子与碳原子通过配位键结合,所以1molFe(CO)5含有10mol配位键;双键C原子的杂化方式为sp2、三键C原子的杂化方式为sp,由图2可知,分子中既有三键C又有双键C,所以图2中C原子的杂化方式为sp、sp2;Fe、C、O、Co四种元素中,O元素非金属性最强,所以电负性最大的是O元素;
(3)金属钴的堆积方式为六方最密堆积,其配位数是12;利用“均摊原则”,Co原子数=![]() ;该晶胞的边长为anm,高为cnm,晶胞的体积为
;该晶胞的边长为anm,高为cnm,晶胞的体积为![]() ,该晶胞的密度为
,该晶胞的密度为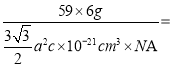
![]() g·cm-3。
g·cm-3。


科目:高中化学 来源: 题型:
【题目】香豆素类化合物具有抗病毒、抗癌等多种生物活性,香豆素-3-羧酸可由水杨醛制备。
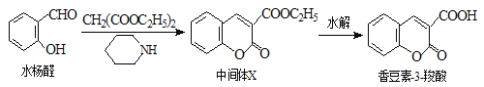
下列说法正确的是( )
A.水杨醛分子中所有原子可能处于同一平面上
B.香豆素-3-羧酸能使酸性高锰酸钾溶液褪色
C.中间体X易溶于水
D.水杨醛的不饱和度是4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述及解释正确的是
A. 2NO2(g)(红棕色)![]() N2O4(g)(无色) ΔH<0,在平衡后,对平衡体系采取缩小容积、增大压强的措施,因为平衡向正反应方向移动,故体系颜色变浅
N2O4(g)(无色) ΔH<0,在平衡后,对平衡体系采取缩小容积、增大压强的措施,因为平衡向正反应方向移动,故体系颜色变浅
B. H2(g)+I2(g)![]() 2HI(g) ΔH<0,在平衡后,对平衡体系采取增大容积、减小压强的措施,因为平衡不移动,故体系颜色不变
2HI(g) ΔH<0,在平衡后,对平衡体系采取增大容积、减小压强的措施,因为平衡不移动,故体系颜色不变
C. FeCl3+3KSCN![]() Fe(SCN)3(红色)+3KCl,在平衡后,加少量KCl,因为平衡向逆反应方向移动,故体系颜色变浅
Fe(SCN)3(红色)+3KCl,在平衡后,加少量KCl,因为平衡向逆反应方向移动,故体系颜色变浅
D. 对于N2+3H2![]() 2NH3,平衡后,压强不变,充入O2,平衡左移
2NH3,平衡后,压强不变,充入O2,平衡左移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.向1 L 1 mol·L-1 NaClO溶液中通入足量CO2,溶液中HClO的分子数为NA
B.标准状况下,体积均为2.24 L的CH4与H2O含有的电子总数均为NA
C.2 mol NO与1 mol O2在密闭容器中充分反应,产物的分子数为2NA
D.由13 g乙酸与2 g CO(NH2)2(尿素)形成的混合物中含有的氢原子总数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知醋酸、醋酸根离子在溶液中存在下列平衡:
CH3COOH+H2O | K1=1.75×10-5mol·L-1 |
CH3COO-+H2O | K2=5.71×10-10mol·L-1 |
现将 50 mL 0.2 mol·L-1醋酸与 50 mL 0.2 mol·L-1醋酸钠溶液混合制得溶液甲,下列叙述正确的是
A.溶液甲的pH>7
B.对溶液甲进行微热,K1、K2同时增大
C.若在溶液甲中加入少量的 NaOH 溶液,溶液的 pH 明显增大
D.若在溶液甲中加入 5 mL 0.1 mol·L-1的盐酸,则溶液中醋酸的 K1 会变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向1 L 0.1 mol·L-1 NH4Cl溶液中,不断加入固体NaOH后,NH![]() 与NH3 · H2O的变化趋势如下图所示(不考虑体积变化和氨的挥发),下列说法不正确的是( )
与NH3 · H2O的变化趋势如下图所示(不考虑体积变化和氨的挥发),下列说法不正确的是( )
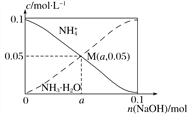
A. 在M点时,n(OH-)-n(H+)=(a-0.05) mol
B. 随着NaOH的加入,![]() 不断增大
不断增大
C. M点溶液中水的电离程度比原溶液小
D. 当n(NaOH)=0.1 mol时,c(OH-)>c(Cl-)-c(NH3·H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向盛50mL0.100mol·L-1盐酸的两个烧杯中各自匀速滴加50mL的蒸馏水、0.100mol·L-1醋酸铵溶液,测得溶液pH随时间变化如图所示。已知Ka(CH3COOH)=1.8×10-5,Kb(NH3·H2O)=1.8×10-5。下列说法正确的是( )
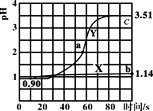
A.曲线X是盐酸滴加蒸馏水的pH变化图,滴加过程中溶液各种离子浓度逐渐减小
B.曲线Y上的任意一点溶液中均存在c(CH3COO-)<c(NH4+)
C.a点溶液中n(Cl-)+n(CH3COO-)+n(OH)-n(NH4+)=0.01mol
D.b点溶液中水电离的c(H+)是c点的102.37倍
查看答案和解析>>
科目:高中化学 来源: 题型:
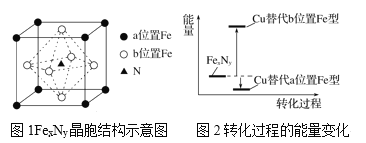
【题目】铁氮化合物(FexNy)在磁记录材料领域有着广泛的应用前景。某FexNy的制备需铁、氮气、丙酮和乙醇参与。
(1)丙酮(CH3COCH3)分子中2号碳原子轨道的杂化类型是__,1mol丙酮分子中含有σ键的数目为___mol。
(2)C、H、O三种元素的电负性由小到大的顺序为__。(请填写元素名称,不要加任何连接符号)
(3)某FexNy的晶胞如图1所示,Cu可以完全替代该晶体中a位置Fe或者b位置Fe,形成Cu替代型产物Fe(x-n)CunNy。FexNy转化为两种Cu替代型产物的能量变化如图2所示,其中更稳定的Cu替代型产物的化学式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2—CaO作电解质,利用图示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛。下列说法中不正确的是( )
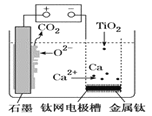
A.由TiO2制得1mol金属Ti,理论上外电路转移4mol电子
B.阳极的电极反应式为2O2--4e-=O2↑
C.在制备金属钛前后,整套装置中CaO的总量会不断减少
D.装置中石墨电极材料需要定期更换
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com