
分析 Na2SO4与CO、H2在高温和铁做催化剂条件下反应,0.1molNa2SO4参加反应转移0.8mol电子,硫元素被还原,令硫元素在还原产物化合价中化合价为x,则0.1×(6-x)=0.8,解得x=-2,所以硫化钠被还原为Na2S,消耗标况下H2的体积为4.48L,n(H2)=$\frac{4.48L}{22.4L/mol}$=0.2mol,氢气提供的电子为0.2mol×2=0.4mol,所以有0.4mol电子是CO提供,CO被氧化为CO2,需CO为$\frac{0.4mol}{2}$=0.2mol,则硫酸钠、氢气和CO的个数之比=0.1mol:0.2mol:0.2mol=1:2:2,根据反应物、生成物和反应条件书写方程式.
解答 解:Na2SO4与CO、H2在高温和铁做催化剂条件下反应,0.1molNa2SO4参加反应转移0.8mol电子,硫元素被还原,令硫元素在还原产物化合价中化合价为x,则0.1×(6-x)=0.8,解得x=-2,所以硫化钠被还原为Na2S,消耗标况下H2的体积为4.48L,n(H2)=$\frac{4.48L}{22.4L/mol}$=0.2mol,氢气提供的电子为0.2mol×2=0.4mol,所以有0.4mol电子是CO提供,CO被氧化为CO2,需CO为$\frac{0.4mol}{2}$=0.2mol,则硫酸钠、氢气和CO的个数之比=0.1mol:0.2mol:0.2mol=1:2:2,根据反应物、生成物和反应条件书写方程式为Na2SO4+2CO+2H2$\frac{\underline{催化剂}}{△}$Na2S+2CO2+2H2O,
故答案为:Na2SO4+2CO+2H2$\frac{\underline{催化剂}}{△}$Na2S+2CO2+2H2O.
点评 本题考查化学方程式的书写,为高频考点,侧重考查学生分析计算能力,正确判断硫酸钠的还原产物是解本题关键,注意转移电子守恒的正确运用,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 用蒸馏水湿润的试纸测某溶液的pH,一定会使结果偏低 | |
| B. | 可用酸式滴定管准确量取10.00mLKMnO4溶液 | |
| C. | 在中和热测定实验中,不能用温度计来搅拌溶液 | |
| D. | 将乙烯通入酸性高锰酸钾溶液,可检验乙烯的还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
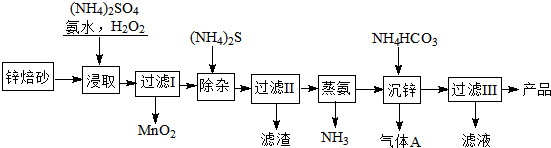
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol任何气体都含有相同的原子数 | |
| B. | 1molO2中含有6.02×1023个氧分子 | |
| C. | 1molH2中含有1mol氢原子和2mol电子 | |
| D. | 1molH2SO4中含有6NA个原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应中生成(2g+h)molH2O | B. | 2d+3f=3g+h | ||
| C. | 2<3g+h<3 | D. | h随着d增大而增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(NH3)=0.010mol/(L•s) | B. | v(O2)=0.0010mol/(L•s) | ||
| C. | v(NO)=0.0010mol/(L•s) | D. | v(H2O)=0.045mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠和氧气反应,条件不同,产物则不同 | |
| B. | 钠原子的最外层只有一个电子 | |
| C. | 钠的化学性质很活泼,少量的钠可以保存在煤油中 | |
| D. | 当钠与硫酸铜溶液反应时,有大量红色固体铜出现 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com