
【题目】Na及其化合物是生活、生产实践中的重要物质.请回答下列有关问题.
(1)钠跟水剧烈反应,生成和 , 此实验说明钠的化学性质活泼.
(2)钠有两种氧化物,其中用于呼吸面具和潜水艇中作为氧气来源的氧化物是 , 该物质中氧元素的化合价为 .
(3)固体碳酸钠中含有碳酸氢钠杂质,除去此杂质的简单方法是 .
【答案】
(1)氢氧化钠,氢气
(2)过氧化钠,﹣1
(3)2NaHCO3 ![]() Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
【解析】(1)钠和水反应方程式为:2Na+2H2O=2NaOH+H2↑,
所以答案是:氢氧化钠、氢气;
(2)过氧化钠和水、二氧化碳反应方程式为:2Na2O2+2H2O=4NaOH+O2↑、2N2O2+2CO2=2Na2CO3+O2↑,氧化钠和水、二氧化碳反应都不生成氧气,过氧化钠中氧元素的化合价为﹣1,
所以答案是:过氧化钠;﹣1;
(3)碳酸钠较稳定,碳酸氢钠不稳定,加热条件下易分解生成碳酸钠,2NaHCO3 ![]() Na2CO3+CO2↑+H2O,所以采用加热的方法除去碳酸氢钠,
Na2CO3+CO2↑+H2O,所以采用加热的方法除去碳酸氢钠,
所以答案是:2NaHCO3 ![]() Na2CO3+CO2↑+H2O.
Na2CO3+CO2↑+H2O.
【考点精析】本题主要考查了钠的化学性质的相关知识点,需要掌握钠的化学性质:与非金属反应;与水反应;与酸反应;与盐溶液反应才能正确解答此题.


科目:高中化学 来源: 题型:
【题目】某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g)+xB(g)2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化如图所示.下列说法中正确的是( )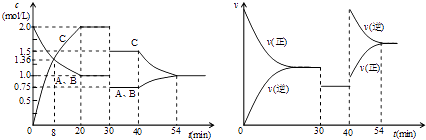
A.30min时降低温度,40min时充入生成物C
B.0~8min内A的平均反应速率为0.08mol/(Lmin)
C.反应方程式中的x=1,正反应为吸热反应
D.20min~40min间该反应的平衡常数均为8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期。B元素含有3个能级,且毎个能级所含的电子数相间;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子。请回答下列问题:
(1)请写出:D基态原子的价层电子排布图__________;F基态原子的外围电子排布式:_________。
(2)下列说法错误的是_________。
A.二氧化硅的相对分子质量比二氧化碳大,所以沸点:SiO2>CO2
B.电负性顺序:B<C<D
C.N2与CO为等电子体,结构相似。
D.稳定性:H2O>H2S,水分子更稳定的原因是水分子间存在氢键
(3)F离子是人体内多种酶的辅因子,人工模拟酶是当前研究的热点。向F硫酸盐溶液中通入过量的C与A形成的气体X可生成[F (X)4]2+,该离子的结构式为______(用元素符号表示)。
(4)某化合物与F(I)(I表示化合价为+1)结合形成图1所示的离子,该离子中碳原子的杂化方式有________。
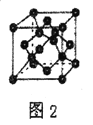
(5)B单质的一种同素异形体的晶胞如图2所示,则一个晶胞中所含B原子数为_______。
(6)D与F形成离子个数比为1:1的化合物,晶胞与NaCl类似,设D离子的半径为a pm, F离子的半径b pm,求该晶胞的空间利用率________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于1.5mol NH3的说法错误的是( )
A.摩尔质量为17 gmol﹣1
B.所含的分子数目约为9.03×1023
C.在标准状况下体积约为33.6L
D.溶于水制成0.5L溶液时物质的量浓度为1.5molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌钡白是一种白色颜料,工业上由ZnSO4与BaS溶液混合而成,BaS+ZnSO4=ZnS↓+BaSO4↓。请根据以下工业生产流程回答有关问题。

Ⅰ.ZnSO4溶液的制备与提纯:
有关资料:
a.菱锌矿的主要成分是ZnCO3,含少量SiO2、FeCO3、Cu2(OH)2CO3等;
b.Zn(OH)2与Al(OH)3相似,能溶于过量的NaOH溶液生成Na2ZnO2;
(1)为了达到综合利用、节能减排的目的,上述流程步骤④中的CO2可以来自于步骤____(选填①、②、③或⑤)。
(2)若步骤缺少②中加入的氧化剂为H2O2,写出反应的离子方程式_____________。
(3)滤渣2中主要成分为____________________(填化学式)。
(4)写出步骤④后产生滤渣3的反应的离子方程式________________。
(5)滤液3中含碳粒子的浓度大小顺序为_____________。
Ⅱ.BaS溶液的制备

(6)写出“煅烧还原”反应的化学方程式_____________。BaSO4和BaCO3的Ksp数值接近,用平衡原理解释为什么BaCO3可溶于盐酸,而BaSO4难溶:______________。
Ⅲ.制取锌钡白
(7)如果上述工业生产流程中步骤⑤硫酸过量,则ZnSO4与BaS溶液混合制取锌银白产生的后果是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A是石油裂解气的主要产物之一,其产量是衡量一个国家石油化工发展水平的标志。下列是有机物A~G之间的转化关系:
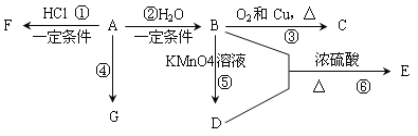
请回答下列问题:
(1)A、D中所含官能团的名称分别是_______________;C的结构简式是_____________;
(2)E是一种具有香味的液体,由B + D→E的反应方程式为:______________,反应类型是________。
(3)G是一种高分子化合物,其结构简式是____________________________________;
(4)俄罗斯足球世界杯激战正酣,在比赛中当运动员肌肉扭伤时,队医立即对其受伤部位喷射物质F进行应急处理。写出由A制F的化学反应方程式:___________。
(5)H是E的同分异构体,且H能与NaHCO3反应,则H的结构简式可能为(写出2种):_____________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质A是生产各种塑料的重要单体,工业上采用物质B分解制备物质A的同时释放出氢气,其制备原理是:
B(g)A(g)+H2(g)△H=+125kJmol﹣1
(1)该反应的平衡常数表达式为K= . 随着温度的升高,K值(填“增大”、“减小”或“不变”).
(2)实际生产中常以高温水蒸气作为反应体系的稀释剂(稀释剂不参加反应).物质B的平衡转化率与水蒸气的用量、体系总压强关系如图.
①由图可得出:
结论一:其他条件不变,水蒸气的用量越大,平衡转化率越;
结论二:
②加人稀释剂能影响反应物B的平衡转化率的原因是: .
(3)某些工艺中,在反应的中途加入O2和特定的催化剂,有利于提高B的平衡转化率.试解释其原因: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com