
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案科目:高中化学 来源:不详 题型:填空题
| A.①②④ | B.②④ | C.①②④⑤ | D.全部 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 好的溶液倒入用蒸馏水洗净而末干的试剂瓶中备用
好的溶液倒入用蒸馏水洗净而末干的试剂瓶中备用查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 B偏低、C无影响)
B偏低、C无影响)查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 实验操作 | 实验目的或结论 |
| A | 向含有少量FeCl3的MgCl2溶液中加入足量Mg(OH)2粉末,搅拌一段时间后过滤 | 除去MgCl2溶液中少量的FeCl3 |
| B | 向某溶液中加入BaCl2溶液生成白色沉淀,继续加稀硝酸沉淀不消失 | 证明溶液中含SO42- |
| C | 向某溶液中加入稀盐酸,放出无色无味的气体,将气体通入澄清石灰水,石灰水变浑浊 | 证明该溶液中存在CO32- |
| D | 向0.1mol/LFe SO4溶液中滴加少量酸性KMnO4溶液,KMnO4溶液褪色 | 证明Fe2+具有氧化性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 加入过
加入过 量的除杂质试剂。某校化学课外活动小组为了除去粗盐中含有少量Na2SO4、MgCl2,设计了下列实验步骤:
量的除杂质试剂。某校化学课外活动小组为了除去粗盐中含有少量Na2SO4、MgCl2,设计了下列实验步骤: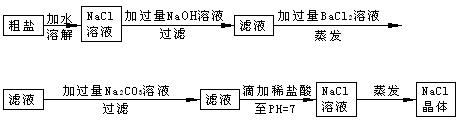
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
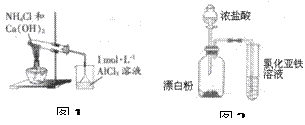
| A.除去KCl溶液中混有的BaCl2,所加试剂的顺序: Na2CO3溶液、HCl溶液 |
| B.图1烧杯中先出现白色沉淀后溶解 |
| C.用如图2装置验证氧化性:ClO->Cl2>Fe3+ |
| D.在NaHSO3溶液中滴入石蕊试液,验证溶液NaHSO3中存在水解平衡 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 实验操作 | 实验目的或结论 |
| A | 某钾盐溶于盐酸,产生能使澄清石灰水变浑浊的无色无味气体 | 说明该钾盐是K2CO3 |
| B | 向含有少量FeCl3的MgCl2溶液中加入足量Mg(OH)2粉末,搅拌一段时间后过滤 | 除去MgCl2溶液中少量FeCl3 |
| C | 常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生 | 说明常温下K sp(BaCO3)<K sp(BaSO3) |
| D | C2H5OH与浓硫酸170℃共热,制得的气体通入酸性KMnO4溶液 | 检验制得的气体是否为乙烯 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 量;加热至110℃,恒温一段时间,至于空气中冷却,称量并记录质量;计算结晶水含量。请纠正实验过程中的两处错误;_________;_________。
量;加热至110℃,恒温一段时间,至于空气中冷却,称量并记录质量;计算结晶水含量。请纠正实验过程中的两处错误;_________;_________。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com